
| A. | Y<Z<X | B. | X<Y<Z | C. | Z<Y<X | D. | Y<X<Z |
分析 X元素的阴离子与Y、Z元素的阳离子具有相同的电子层结构,可知X在Y、Z的上一周期,结合具有相同电子排布的离子中,原子序数大的离子半径小来解答.
解答 解:有X、Y、Z三种主族元素,若X元素的阴离子与Y、Z元素的阳离子具有相同的电子层结构,可知X在Y、Z的上一周期,则X的原子序数最小;
由具有相同电子排布的离子中,原子序数大的离子半径小,且Y元素的阳离子半径大于Z元素的阳离子半径,则Y的原子序数小于Z的原子序数,
即此三种元素的原子序数大小顺序是X<Y<Z,
故选B.
点评 本题考查原子结构及元素周期律,为高频考点,把握元素的位置、电子层结构推断原子序数关系为解答的关键,侧重分析与应用能力的考查,注意元素的相对位置,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. | 饱和Ca(OH)2溶液 |
| B | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | Ca(ClO)2溶液 |
| C | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. | Ca(OH)2溶液 |
| D | 通入NH3,溶液变浑浊.继续通NH3至过量,浑浊消失. | NaAlO2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 铁与稀HNO3反应:Fe+2H+=═Fe2++H2↑ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-═Fe3++2H20+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
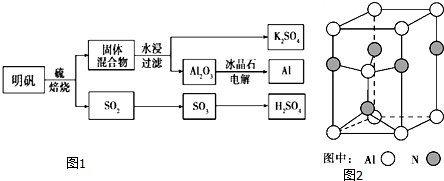
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
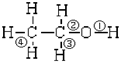
| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和④断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
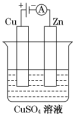 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ④>③>②>① | C. | ④>③>①>② | D. | ①>④>③>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com