
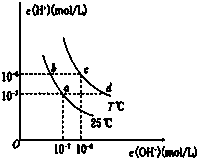
 如图表示水溶液中c(H+)与c(OH-)的关系.
如图表示水溶液中c(H+)与c(OH-)的关系.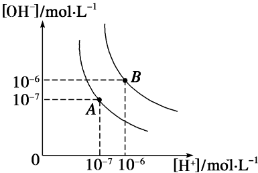
| 10-12 |
| 10-9 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
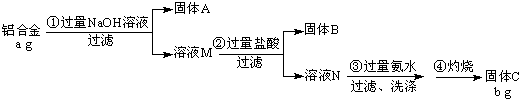
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中阳离子向负极移动 |
| B、用铝质铆钉接铁板,铁易被腐蚀 |
| C、粗铜精炼时,粗铜接直流电源的正极 |
| D、白铁(镀锌)的表面一旦破损,铁腐蚀加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 碳酸氢铵与足量NaOH溶液混合反应:NH4++OH-=NH3?H2O | 错误,漏掉了HCO3-与OH-的离子反应 |
| B | 常温条件下,0.01mol?L-1的K2S溶液中:c(K+): c(S2-)>2 | 正确,部分S2-发生水解 |
| C | 足量硫酸铝溶液与碳酸氢钠溶液混合反应:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | 正确,Al3+与HCO3-相互促进水解 |
| D | AlCl3溶液中加入过量氨水: Al3++3NH3?H2O═Al(OH)3↓+3NH4+ | 错误,产物应该是[Al(OH)4]- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
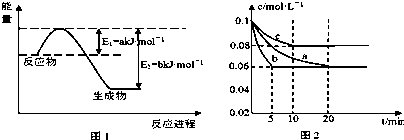
| T/(K) | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 除杂质的试剂 | 除杂质的方法 |
| 苯(苯酚) | (1) | (4) |
| 酒精(水) | (2) | (5) |
| 乙酸乙酯(乙酸) | (3) | (6) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com