
| A、用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g) |
| B、用玻璃棒蘸取某溶液滴在pH试纸上,可测得的溶液pH=2.9 |
| C、在100 mL容量瓶中溶解4.0 g NaOH,可得到1.0 mol/L的NaOH溶液 |
| D、由水的离子积常数Kw随温度升高而增大的事实,可判断水电离是吸热过程 |


科目:高中化学 来源: 题型:
| 容器编号 | c[H2O(g)] | c[CO(g)] | c[H2(g)] | v(正)、v(逆)关系 |
| Ⅰ | 0.06 | 0.60 | 0.10 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | ? |
| Ⅲ | 0.16 | 0.50 | 0 | ? |
| Ⅳ | 0.12 | 0.30 | ? | v(正)=v(逆) |
| A、在容器Ⅲ中,反应达到平衡时放出的热量为13.13kJ |
| B、若将平衡时Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态 |
| C、在容器Ⅱ中,v(正)<v(逆) |
| D、在容器Ⅳ中,H2的浓度为0.50mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
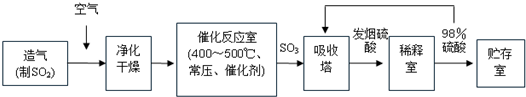
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ |
| B、含有碳酸氢钠的溶液:K+、SO42-、Cl-、H+ |
| C、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| D、水电离出的c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24g Mg变为Mg2+时失去的电子数为2NA |
| B、常温常压下,11.2LN2中含有的分子数为0.5NA |
| C、1L 0.1mol/LNaNO3溶液中含有的钠离子数为0.1NA |
| D、32g O2中含有氧原子的个数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com