
| 容器编号 | c[H2O(g)] | c[CO(g)] | c[H2(g)] | v(正)、v(逆)关系 |
| Ⅰ | 0.06 | 0.60 | 0.10 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | ? |
| Ⅲ | 0.16 | 0.50 | 0 | ? |
| Ⅳ | 0.12 | 0.30 | ? | v(正)=v(逆) |
| A、在容器Ⅲ中,反应达到平衡时放出的热量为13.13kJ |
| B、若将平衡时Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态 |
| C、在容器Ⅱ中,v(正)<v(逆) |
| D、在容器Ⅳ中,H2的浓度为0.50mol?L-1 |
| 0.60×0.10 |
| 0.06 |
| (0.5+x)×x |
| 0.16-x |
| 0.06+0.12 |
| 2 |
| 0.6+0.3 |
| 2 |
| 0.1+0.4 |
| 2 |
| 0.45×0.25 |
| 0.09 |
| 1.2×0.2 |
| 0.12 |


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、①③ |
| C、②④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、保持恒容恒温条件,向密闭容器中充入氦气,化学反应速率将变快 |
| B、若容器的容积不变,降低温度,c(CO2)/c(CO)减小 |
| C、保持恒容恒温(T1)条件,8min达化学平衡状态时,v(CO)=0.0625mol/(L?s) |
| D、保持恒容恒温(T1)条件,8min后再加入足量FeO粉末并充入1.5mol的CO气体,重新达到平衡时,CO的转化率为33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可逆反应在一定条件下有一定的限度,当反应进行到一定限度后,反应物不再转化为生成物 |
| B、决定化学反应速率的主要因素是参加反应的物质的性质 |
| C、化学反应的速率和限度均可通过改变化学反应条件而改变 |
| D、化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
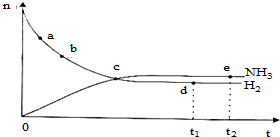 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、点c处用氨气的浓度表示的速率等于用氢气的浓度表示的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中加入稀硫酸再加入铜粉,共热,铜粉溶解且有红棕色气体产生,说明原溶液中含有NO3- |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色产物生成且能溶于浓硝酸 |
| C、某溶液中加入NaOH溶液,加热能产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中含有NH4+ |
| D、在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g) |
| B、用玻璃棒蘸取某溶液滴在pH试纸上,可测得的溶液pH=2.9 |
| C、在100 mL容量瓶中溶解4.0 g NaOH,可得到1.0 mol/L的NaOH溶液 |
| D、由水的离子积常数Kw随温度升高而增大的事实,可判断水电离是吸热过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com