
向溶有10.1g KNO3的水溶液中撒入17.28g 铜粉,微热,铜粉不溶解,慢慢滴入2mol·L-1的稀硫酸,
铜粉开始溶解,溶液显蓝色,并有少量气泡出现。该实验中反应的离子方程式:
3 Cu + 8H+ + 2NO3- == 3 Cu 2+ + 2NO ↑ + 4H2O
(1)当滴入 mL硫酸后铜粉不再溶解;此时烧杯底应该残留 g铜粉;
(2)为使杯底的铜粉全部溶解,在加入足量硫酸的前提下,还应该再加入至少 g KNO3固体。
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.无色透明的溶液中: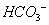 、K+、Na+、MnO4-
、K+、Na+、MnO4-
B.酸性溶液中可能大量存在Na+、ClO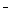 、SO42-、I
、SO42-、I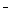
C.含有0.1 mol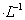 Fe3+ 的溶液中可以大量存在:K+、Mg2+、I-、NO3-
Fe3+ 的溶液中可以大量存在:K+、Mg2+、I-、NO3-
D.室温下,PH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [单位:mol/(L·s)]表示,则正确的关系是:( )
A.4/5v(NH3)=v(O2) B.5/6 v(O2)=v(H2O) C.2/3 v(NH3)=v(H2O) D.4/5 v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)变黑后,黑色物质会继续与浓硫酸作用产生两种气体,这种黑色物质与浓硫酸作用的化学方程式为__________________________________________________________________
(2)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有_____________(填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
某种固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.则下列判断错误的是( )

|
| A. | a极为电池负极,电极反应为:O2+4e﹣═2O2﹣ |
|
| B. | 有CH4放电的b极为电池的负极 |
|
| C. | 该电池的总反应为:CH4+2O2=2H2O+CO2 |
|
| D. | b极对应的电极反应为:CH4﹣8e﹣+4O2﹣═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1mol碱式碳酸铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH.下列有关叙述不正确的是( )
|
| A. | 电解过程产生的气体体积(在标准状况下)为5.6L |
|
| B. | 电解过程转移的电子数为3.612×1023个 |
|
| C. | 电解过程只发生了2CuSO4+2H2O |
|
| D. | 加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
Al是生活中常见的金属,工业上制备金属铝的原料可从铝土矿(主要成分是
Al2O3,MgO,Fe2O3等)中提取,其流程如下,请回答下列问题:
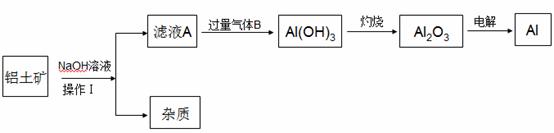
(1)操作Ⅰ是 ,气体B的化学式是
(2)由滤液A生成Al(OH)3的离子方程式是
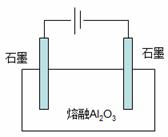 (3)工业上采用右图装置电解熔融Al2O3制备金属铝,该电
(3)工业上采用右图装置电解熔融Al2O3制备金属铝,该电
解池阳极的电极反应为 ,若电解一
段时间后,阳极的石墨损失了54g,且生成的CO与CO2的物质的
量之比为2:1,则阴极生成的产物质量为 g。
(4)微量元素铍在海水中主要以Be(OH)+形式存在,
其性质与铝元素相似,则Be(OH)+与强碱溶液反应的离子方程式为: ,研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是 。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1:2: 3,则三种硫酸盐的物质的量浓度之比为 ( )
A 1:2:3 B 1:3:3 C 1:6:9 D 1:3:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com