
【题目】下列关于某物质是否为电解质的判断正确的是
A. 固体氯化钠不导电,所以氯化钠不是电解质
B. 氯化氢水溶液能导电,所以氯化氢是电解质
C. SO2溶于水能导电,所以SO2是电解质
D. 氨水能导电,所以氨水是电解质
科目:高中化学 来源: 题型:
【题目】(12分) 某实验小组用下图装置进行乙醇催化氧化的实验。Z.X.X.K]
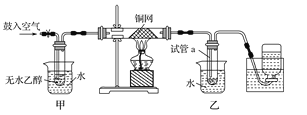
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是 反应(放热或吸热)。
(2)甲和乙两个水浴作用不相同。甲的作用是 ;
乙的作用是 。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 ,
集气瓶中收集到的气体的主要成分是 。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可先在混合液中加入 (填写字母)。然后,再通过 (填实验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、E、G均是原子序数小于36的元素,XZ2是引起温室效应的主要气体,Z、M同主族且M最外层电子数是电子层数的2倍。Y元素的基态原子最外层有3个未成对电子,次外层有2个电子。N2+核外3d有9个电子,E和 G在周期表中既处于同一周期也处于同一族,且原子序数E比G小2。请回答下列问题:(所有化学式均以元素符号表示)
(1)写出G的外围电子排布式________,X、Y、Z的电负性最大的为___________
(2)XZ32—中中心原子杂化方式为_____________。
(3)比较Z的氢化物(H2Z)和M的氢化物(H2M)的稳定性强弱,并解释其原因是____________。
(4)N与Y可形成的一种具有良好的电学和光学性能的化合物,其晶胞结构如右图所示,则该化合物的化学式为__________。

(5)根据其能量变化示意图,请写出YZ和XZ2反应的热化学方程式 ______________。

(6)检验二价E离子可采用的方法为:在含有这种离子的溶液中加入某种试剂,出现特征蓝色沉淀,其对应的离子方程式是______________。且E在一定条件下可形成体心立方堆积的晶体,设E原子半径为r,请用含r的代数式表示该晶体空间利用率_______________.(不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将AlCl3、MgCl2、MgSO4、Al2(SO4)3四种物质溶于水,形成的混合溶液中c(Al3+)=0.1mol·L-1、c(Mg2+)=0.25mol·L-1、c(Cl-)=0.2mol·L-1,则该溶液中c(SO42-)为
A. 0.15mol·L-1
B. 0.20mol·L-1
C. 0.25mol·L-1
D. 0.30mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图装置的叙述中,正确的是

A. 若X为铁棒, Y为NaCl溶液, 开关K置于M处, 可减缓铁的腐蚀, 这种方法称为外接电源的阴极保护法
B. 若整个装置为电解精炼铜的装置,则X为粗铜,Y为硫酸铜溶液,开关K置于N处。且电解过程中硫酸铜溶液浓度不变
C. 若X为碳棒, Y为氯化铜溶液, 开关K置于N处, 当产生11.2L气体时,右侧碳棒质量增加6.4g
D. 若X为碳棒, Y为氯化钠溶液, 开关K置于N处, 当电路中有0.01mol电子流过时,假设此时该溶液为100mL,则常温下其pH为13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物种类繁多的主要原因是 ( )
A. 有机物的分子结构十分复杂
B. 碳原子能与其他原子形成四个共价键,且碳原子之间也能互相成键
C. 有机物除含碳元素外,还含有其他多种元素
D. 自然界中存在多种形式的、大量的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 18g H216O 和20g H218O 含有的质子数均为10NA
B. 1L 1mol/L的KAl(SO4)2 溶液中阳离子总数为2NA
C. 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA
D. 反应N2+3H2 ![]() 2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)![]() 2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是

A. C点对应状态的平衡常数K(C)=10-3.638
B. 该反应的△H>0
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30 ℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去KCl溶液中含有的少量K2SO4和CaCl2,下列各操作:①加热蒸发;②加过量BaCl2溶液;③加适量盐酸;④加过量K2CO3;⑤过滤。顺序正确的是 ( )
A. ②③④⑤① B. ②④⑤③① C. ①②③④⑤ D. ④③②⑤①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com