
【题目】二甲醚是一种重要的清洁燃料,也可替代氟氯昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)下列可以说明反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)已经达到平衡状态的是________________(填字母代号)。
CO2(g)+H2(g)已经达到平衡状态的是________________(填字母代号)。
A.单位时间内一个H-H键断裂的同时有两个H-O键断裂
B.H2O与CO2的浓度相等
C.温度和体积一定时,容器内的压强保持不变
D.条件一定时,混合气体的平均相对分子质量不再变化
E.温度和体积一定时,CO的浓度保持不变
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
若加入CH3OH后,经过10min反应达到平衡,此时c(CH3OH)=___________。
【答案】Na2CO3+H2S=NaHCO3+NaHS -246.4kJ·mol-1 C、E A、E 0.04mol·L-1
【解析】
(1)已知H2S与Na2CO3溶液反应生成两种酸式盐,则反应后生成NaHCO3和NaHS,该反应的化学方程式为Na2CO3+H2S=NaHCO3+NaHS;
答案为:Na2CO3+H2S=NaHCO3+NaHS;
(2)已知:①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g),则△H=-90.8kJ/mol×2-23.5kJ/mol-41.3kJ/mol=-246.4kJ/mol;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,应使平衡向正反应方向移动,可减少CO2的浓度或分离出二甲醚,由于反应放热,升高温度平衡向逆反应方向移动,转化率减小,催化剂不影响平衡移动,而增加CO的浓度,CO的转化率反而减小;
答案为:-246.4kJ·mol-1;C、E;
(3)反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)是一个气体分子数不变的反应;
CO2(g)+H2(g)是一个气体分子数不变的反应;
A. 单位时间内一个H-H键断裂的同时有两个H-O键断裂,则正逆反应速率相等,已达平衡,A正确;
B. H2O与CO2的浓度相等,不能代表一定处于平衡状态,因为物质的浓度取决于起始物质的量和转化量,B错误;
C. 温度和体积一定时,反应前后气体的分子数、体积和压强均不变,所以压强始终不会变化,所以压强保持不变不能说明达到了平衡状态,C错误;
D. 反应中气体分子数不变,混合气体的平均相对分子质量始终不变,故其不再变化不能说明达到了平衡状态,D错误;
E. 温度和体积一定时,CO的浓度保持不变,则符合平衡状态特征,E正确;
答案为:A、E;
(4)根据方程式计算平衡常数,然后利用三段式法解答,即
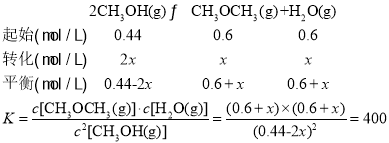
解得x=0.2,所以此时c(CH3OH)=0.04mol·L-1;
答案为:0.04mol·L-1。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amol铁粉加入到含bmol硝酸溶液中,充分反应后铁粉完全溶解,共收集到c L(标况)的NO、NO2混合气体。下列有关说法不正确的是
A. 若反应后产物中只有Fe2+生成,则![]() < a<
< a<![]()
B. 若反应后产物中只有Fe3+生成,则b=3a +![]()
C. 若反应后产物中有Fe2+、Fe3+生成,则![]() <b<6a
<b<6a
D. 若反应后溶液中有dmol H+,则b=3a+d+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g物质完全燃烧时的反应热叫做该物质的热值。有以下能量转化图,下列说法不正确的是( )

A.转化Ⅰ的热化学方程式为:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
B.转化Ⅱ的热化学方程式为:2CO(g)+O2(g)=2CO2(g) ΔH=-565.8 kJ·mol-1
C.由C→CO的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-110.6 kJ·mol-1
D.CO的热值:ΔH=-10.1 kJ·g-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mL B.45mL C.30mL D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
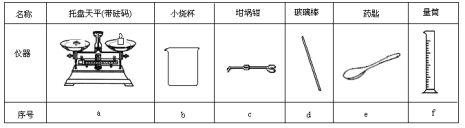
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
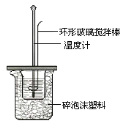
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。根据材料回答下列问题:
(1)铷位于元素周期表的第________周期________族。
(2)关于铷的下列说法中不正确的是________(填数字序号)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳
③Rb2O2与水能剧烈反应并释放出O2
④它是极强的还原剂 ⑤RbOH的碱性比同浓度的NaOH弱
(3)现有铷和另一种碱金属形成的合金5 g,与足量水反应时生成标准状况下的气体2.24 L,则另一碱金属可能是_______________(填元素符号)。
(4)铷久置于空气中,最终变成产物是_____________。
A、Rb2O B、Rb2O2 C、Rb2CO3 D、RbHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com