
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图,下列说法正确的是
已知:①室温下,0.1 mol· L-1 H2C2O4的pH=1.3 ;0.1 mol· L-1NaHC2O4的pH=2.8
②草酸钙(Ca C2O4)难溶于水;
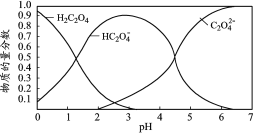
A.pH=4.5的草酸溶液中含有的大量微粒有:H2C2O4、HC2O4-、C2O42-
B.0.1 mol·L1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
C.向H2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:2MnO4-+5C2O42-+16H+=2Mn2+ +10CO2↑ +8H2O
D.向NaHC2O4溶液中加入足量澄清石灰水,产生白色沉淀:2HC2O4- +Ca2++2OH-=Ca C2O4↓ +2H2O+C2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子团SCN化合价为-1价,在很多方面跟卤素原子相似,因此称为“拟卤素”。拟卤素离子与卤离子还原性强弱顺序为Cl-<Br-<SCN-<I-,又知氧化性I2>S,下列反应不正确的是( )
A. (SCN)2+2Br-=Br2+2SCN-
B. (SCN)2+H2S=2H++2SCN-+S↓
C. 4H++2SCN-+MnO2![]() Mn2++(SCN)2↑+2H2O
Mn2++(SCN)2↑+2H2O
D. (SCN)2+2I-=2SCN-+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成 NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质
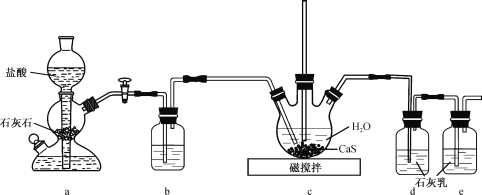
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 ______________________________________;装置b中盛放的试剂是__________________ 。
②装置c中的长直导管的作用是____________________________________,三颈烧瓶中通入CO2 不能过量,原因是 ______________________________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是___________________________;该反应的化学方程式为___________________________________________________________________。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____________(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 __________________________________________________。
③可用酸性KMnO4溶液滴定硫脲,已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42— ,该反应中氧化剂与还原剂的物质的量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)。
已知:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
则反应2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解200 mL饱和食盐水(惰性电极),一段时间后,阴极收集到标况下的氢气2.24 L(设电解后溶液体积不变)。
①二甲醚燃料电池的正极反应式为:___________,负极反应式为:_____________。
②请写出电解食盐水的化学方程式:____________________。
③电解后溶液的c(OH-)=________,理论上消耗二甲醚的质量为________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.48g 正丁烷和 10g 异丁烷的混合物中共价键数目为 13NA
B.标准状况下,22.4LCl2 与水充分反应,转移电子数为 NA
C.标准状况下,1L 液态水中含有的H+数为 10ˉ7NA
D.2.0g D2O 和 H218O 的混合物中含有的质子数和中子数之和为 1.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
A.1mol<n<2molB.1mol<n<4mol
C.2mol<n≤4molD.1mol<n≤4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼矿主要含MoS2,还含有Ca、Si、Cu、Zn、Fe等元素。利用辉钼矿制备仲钼酸铵的新一代清洁生产工艺如下图所示:
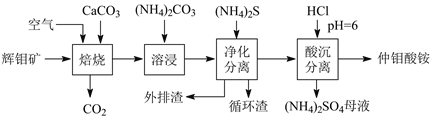
回答下列问题:
(1)焙烧温度为400℃,MoS2转化为CaMoO4和CaSO4,则反应中每摩MoS2转移的电子数为_________。仲钼酸铵(七钼酸铵)中的阴离子是Mo7O24n-,则n=_______。
(2)传统焙烧是在650℃下,使MoS2直接与空气中的O2反应生成MoO3和SO2。图示清洁生产工艺加入CaCO3的优点是______________。
(3)溶浸时,CaMoO4发生复分解反应的化学方程式是___________。循环渣的主要成分是CaCO3,则外排渣主要是________和Cu、Zn、Fe的硫化物。
(4)已知:常温下Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6。在(NH4)2SO4母液中添加循环渣(CaCO3),可以使硫酸铵转化为碳酸铵(返回溶浸循环使用),原因是_______。
(5)电氧化分解钼精矿时,用惰性电极电解钼精矿和NaCl的混合浆液,电解槽无隔膜,控制溶液pH=9。阴极生成物为________,混合浆液中,阳极产物转化生成的NaClO氧化MoS2生成MoO42-和SO42-的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示转化关系中涉及到的物质均由主族元素组成(部分产物已略去),其中C、D为单质,A、B、E、F、G为化合物,除C与D的反应外,其它反应均在溶液中进行。请填写下列空白。
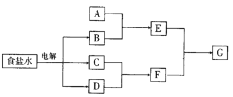
(1) 若A是常见的金属或金属氧化物,当F过量时,G为可溶性盐,则A的化学式为_________或_________。
(2) 若A是一种常见氧化物,不管F过量与否,G为同一种难溶性物质,则A的名称是________,晶体类型是_______,A的用途是_________。
(3) 若A是一种具有漂白性的气态氧化物,A是___;若A是一种无味的气态氧化物,A的电子式为______。
(4) 若A为有机化合物,如果A与G为同一物质,请写出两种A(不同类别物质)的结构简式:_____;_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com