
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成 NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质
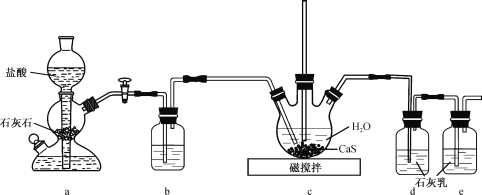
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 ______________________________________;装置b中盛放的试剂是__________________ 。
②装置c中的长直导管的作用是____________________________________,三颈烧瓶中通入CO2 不能过量,原因是 ______________________________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是___________________________;该反应的化学方程式为___________________________________________________________________。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____________(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 __________________________________________________。
③可用酸性KMnO4溶液滴定硫脲,已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42— ,该反应中氧化剂与还原剂的物质的量之比为_____________。
【答案】打开装置a、b 之间的活塞 饱和 NaHCO3 溶液 作安全导管,避免烧瓶内压强过大 CO2过量会使产物CaCO3转化为Ca(HCO3)2,不利于与 Ca(HS)2分离 热水浴 2CaCN2 + Ca(HS)2+ 6H2O ![]() 2CS(NH2)2 + 3Ca(OH)2 FeCl3 用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3 14:5
2CS(NH2)2 + 3Ca(OH)2 FeCl3 用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3 14:5
【解析】
(1)①装置a中,需防止启普发生器内正压力的形成,所以应打开活塞,反应发生的操作为打开装置a、b 之间的活塞;装置b中盛放的试剂,应能除去CO2中混入的HCl,同时又不吸收CO2,所以应加入饱和NaHCO3溶液。答案为:打开装置a、b 之间的活塞;饱和 NaHCO3 溶液;
②当装置c中压力过大时,可通过调节c中的液体量来调节压强,所以长直导管的作用是作安全导管,避免烧瓶内压强过大;实验目的是制取Ca(HS)2,既要考虑生成量,又要考虑分离,因为Ca(HS)2、CaCO3都能与碳酸反应,所以三颈烧瓶中通入CO2 不能过量,原因是 CO2过量会使产物CaCO3转化为Ca(HCO3)2,不利于与Ca(HS)2分离。 答案为:作安全导管,避免烧瓶内压强过大;CO2过量会使产物CaCO3转化为Ca(HCO3)2,不利于与 Ca(HS)2分离;
(2)将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成Ca(OH)2,因为温度不高于100℃且需控制,所以合适的加热方式是热水浴;该反应的化学方程式为2CaCN2 + Ca(HS)2+ 6H2O ![]() 2CS(NH2)2 + 3Ca(OH)2。答案为:热水浴;2CaCN2 + Ca(HS)2+ 6H2O
2CS(NH2)2 + 3Ca(OH)2。答案为:热水浴;2CaCN2 + Ca(HS)2+ 6H2O ![]() 2CS(NH2)2 + 3Ca(OH)2;
2CS(NH2)2 + 3Ca(OH)2;
(3)①验证NH4SCN时,既可验证NH4+,又可验证SCN-,但验证SCN-时效果更好,可用的试剂是FeCl3。答案为:FeCl3;
②检验NH3的方法为用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3。答案为:用湿润的红色石蕊试纸置于试管口,若变蓝则为 NH3;
③已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42- ,则发生反应的离子方程式为5CS(NH2)2+14MnO4-+32H+ =14Mn2++ 5CO2↑+5N2↑+5SO42- +26H2O,该反应中氧化剂为MnO4-,还原剂为CS(NH2)2,二者的物质的量之比为14:5。答案为:14:5。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
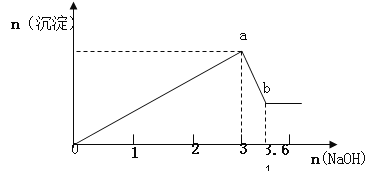
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为_____ ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量各为0.1mol钠、镁、铝单质,分别投入足量盐酸溶液中,生成相同条件下氢气的体积比为___。
(2)物质的量各为0.2mol的铝、铁、锌,分别与100ml1mol/L的硫酸溶液反应,生成相同条件下氢气的体积比为___。
(3)等质量的两份铝分别与足量的盐酸溶液和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】iCo2S4@g-C3N4-CNT是一类很有发展前途的化合物电催化剂。回答下列问题:
(1)基态Co2+的价层电子排布图(轨道表达式)为_________;基态S原子电子占据最高能级的电子云轮廓图为______________形。
(2)g-C3N4(结构片段如图1,环上化学键与苯环类似)可由三聚氰胺(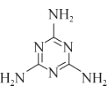 )与(NH4)2SO4共热制得。
)与(NH4)2SO4共热制得。
①g-C3N4分子中环上的氮原子、碳原子杂化方式依次为________、_____。
②SO42—的空间构型为 __________________。
③三聚氰胺分子中含σ键 ______个,它不溶于冷水,溶于热水,其主要原因是 ______________________。
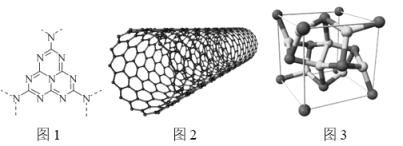
(3)碳纳米管(CNT,结构如图2)具有良好的导电性,其原因是______________。
(4)CoS2具有 AB2型立方结构(如图3),晶胞参数为553.4pm。设NA为阿伏加德罗常数的值,则晶体的密度为________________ gcm—3(列出计算式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为:Fe3++Cr2+![]() Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是

A. 电池充电时,b极的电极反应式为:Cr3++e-=Cr2+
B. 电池放电时,b极的电极反应式为:Fe2+-e-=Fe3+
C. 电池放电时,Cl-从b极穿过选择性透过膜移向a极
D. 电池放电时,电路中每通过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
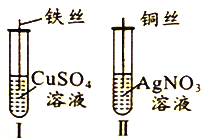
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3molA气体和1.5molB气体在3L的容器中混合并在一定条件发生如下反应: 2A(g)+B(g) ![]() 2C(g)。经2s后测得C的浓度为0.3mol/L,则下列计算正确的是:
2C(g)。经2s后测得C的浓度为0.3mol/L,则下列计算正确的是:
①用A表示的平均反应速率为0.3mol/(L·s)
②2s时物质A的浓度为0.7mol/L
③用B表示的平均反应速率为0.15mol/(L·s)
④2s时物质B的转化率为30%
A.②④B.①④C.②③D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com