
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为_____ ______
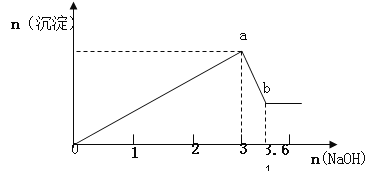
【答案】FeCl3:4mol/L AlCl3:6mol/L
【解析】
根据Al(OH)3+OH-═AlO2-+2H2O、Al3+ + 3OH- ═ Al(OH)3↓、Fe3+ + 3OH-═Fe(OH)3↓反应关系,结合c=![]() 进行计算。
进行计算。
设n(Al3+)=n(Al(OH)3)=x,则由
Al(OH)3+OH-═AlO2-+2H2O
1 1
x (3.6-3)mol
x=(3.6-3)mol=0.6mol,
设n(Fe3+)=y,则
Al3+ + 3OH- ═ Al(OH)3↓
0.6mol 1.8mol 0.6mol
Fe3+ + 3OH-═Fe(OH)3↓
1 3
y (3-1.8)mol
![]() =
=![]()
解得y=0.4mol,
c(FeCl3)=![]() =4mol/L;c(AlCl3)=
=4mol/L;c(AlCl3)=![]() =6mol/L;
=6mol/L;
答:FeCl3、AlCl3的物质的量浓度分别为4mol/L、6mol/L
【点晴】
本题考查金属及化合物的性质,明确发生的化学反应与图象的对应关系是解答本题的关键,然后利用消耗的NaOH的物质的量代入离子反应方程式计算即可解答,重点是要抓住发生的反应有Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,然后结合图中消耗的NaOH的物质的量来计算。


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
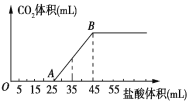
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
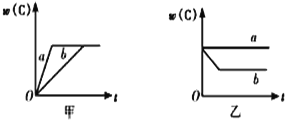
(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则_____曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则____曲线表示恒温恒容的情况,且此时混合气体中w(C)____(填“变大”“变小”或“不变”)。
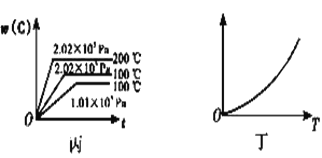
(3)根据丙可以判断该可逆反应的正反应是____(填“放热”或“吸热”)反应,x的值为____。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是_____ (填序号)。
①w(C) ②A的转化率 ③压强 ④c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的某铁的氧化物FexOy与100mL 0.1 mol·L-1 稀硫酸恰好反应完全,得到溶液Z。若用相同质量的该铁的氧化物与CO或H2在高温下反应,反应需要标准状况下CO或H2的体积分别为V1和V2。下列说法正确的是
A.x=2、y=3B.Z溶液一定能使酸性KMnO4溶液褪色
C.V1=V2D.V1和V2的体积不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和铝粉的混合物逐渐加入100mL的稀硝酸中,其产生的有关离子浓度与加入铁粉和铝粉的混合物的质量的关系如下图所示:
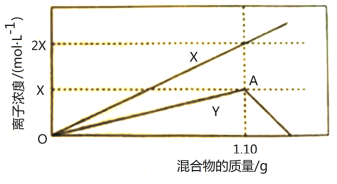
若反应过程中生成的气体为NO,溶液的体积变化忽略不计。请回答下列问题:
(1)X表示的变化离子是_______________(填离子符号)。
(2)OA段发生反应的离子方程式是___________________________________。
(3)稀硝酸溶解1.10g铁粉和铝粉后溶液还能继续溶解混合物的原因是________________
(4)该硝酸的浓度是_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下,![]() 氖气所含有的原子数目为
氖气所含有的原子数目为![]()
B. ![]() 铁粉与
铁粉与![]() 盐酸完全反应转移电子的数目为
盐酸完全反应转移电子的数目为![]()
C. 标准状况下,![]() 和
和![]() 混合体系中含有的硫原子数目为
混合体系中含有的硫原子数目为![]()
D. 常温常压下![]() 的乙烯(
的乙烯(![]() )和丙烯(
)和丙烯(![]() )混合气体中含有的原子数为
)混合气体中含有的原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图,下列说法正确的是
已知:①室温下,0.1 mol· L-1 H2C2O4的pH=1.3 ;0.1 mol· L-1NaHC2O4的pH=2.8
②草酸钙(Ca C2O4)难溶于水;
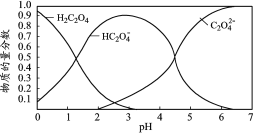
A.pH=4.5的草酸溶液中含有的大量微粒有:H2C2O4、HC2O4-、C2O42-
B.0.1 mol·L1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
C.向H2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:2MnO4-+5C2O42-+16H+=2Mn2+ +10CO2↑ +8H2O
D.向NaHC2O4溶液中加入足量澄清石灰水,产生白色沉淀:2HC2O4- +Ca2++2OH-=Ca C2O4↓ +2H2O+C2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取某固体样品,进行如下实验:
①取a g样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊;
②取20mL溶液,加入足量氯水,无气体产生,再加入CCl4后分层,下层为橙红色;
③将②中溶液分液后,在上层溶液加入足量![]() 和盐酸,产生白色沉淀4.66g;
和盐酸,产生白色沉淀4.66g;
④另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体;
该固体样品可能是( )
A. NH4Cl NaBr (NH4)2SO4
B. CuBr2 NaCl (NH4)2SO3
C. NaBr Na2CO3 (NH4)2SO4
D. NaCl NaBr (NH4)2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成 NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质
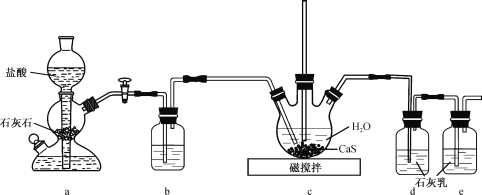
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 ______________________________________;装置b中盛放的试剂是__________________ 。
②装置c中的长直导管的作用是____________________________________,三颈烧瓶中通入CO2 不能过量,原因是 ______________________________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是___________________________;该反应的化学方程式为___________________________________________________________________。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____________(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 __________________________________________________。
③可用酸性KMnO4溶液滴定硫脲,已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42— ,该反应中氧化剂与还原剂的物质的量之比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com