
【题目】取某固体样品,进行如下实验:
①取a g样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊;
②取20mL溶液,加入足量氯水,无气体产生,再加入CCl4后分层,下层为橙红色;
③将②中溶液分液后,在上层溶液加入足量![]() 和盐酸,产生白色沉淀4.66g;
和盐酸,产生白色沉淀4.66g;
④另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体;
该固体样品可能是( )
A. NH4Cl NaBr (NH4)2SO4
B. CuBr2 NaCl (NH4)2SO3
C. NaBr Na2CO3 (NH4)2SO4
D. NaCl NaBr (NH4)2SO3
【答案】D
【解析】
根据每一个实验步骤得出相应的结论进行排除,考虑定性的同时注意定量的关系。
实验步骤①:取ag样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊,说明各物质间不能发生反应生成沉淀,所给的选项B中各物质间会反应生成沉淀,B项排除;
实验步骤②:取20mL溶液,加入足量氯水,无气体产生,据此排除C项,C项会产生CO2气体;再加入CCl4后液体分层,下层为橙红色,说明原溶液中含有溴离子,A项和D项均符合;
实验步骤③:将步骤②中溶液分液后,在上层溶液加入足量BaCl2和盐酸,产生白色沉淀4.66g,这显然是0.02mol的BaSO4沉淀,A项有SO42-,D项有SO32-可被氯水氧化为SO42-,所以A项和D项均符合;
实验步骤④:另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体,该气体为0.02mol的氨气,说明原溶液中含有NH4+,则20mL原溶液中含有的NH4+应为0.04mol,即从量上来看,N和S原子的物质的量之比应是2:1,A项中N和S的物质的量之比明显大于2:1,不符合,而D项中N和S的物质的量之比恰好为2:1,所以答案选择D项。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】![]() 是被广泛应用的金属之一,铜器件在空气中久置会生成铜锈:
是被广泛应用的金属之一,铜器件在空气中久置会生成铜锈:![]() 。回答下列问题:
。回答下列问题:
(1)![]() 元素在元素周期表中的位置为________,基态
元素在元素周期表中的位置为________,基态![]() 原子的核外电子排布式为________,基态
原子的核外电子排布式为________,基态![]() 有________个未成对电子。
有________个未成对电子。
(2)参与生成铜锈的物质![]() 中
中![]() 原子的杂化方式为________,
原子的杂化方式为________,![]() 分子的空间构型是________。
分子的空间构型是________。
(3)![]() 的晶体类型是________,
的晶体类型是________,![]() 含________
含________![]() σ键。
σ键。
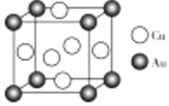
(4)![]() 、
、![]() 可形成金属互化物,其晶胞结构如图所示,若该
可形成金属互化物,其晶胞结构如图所示,若该![]() 、
、![]() 金属互化物的密度为
金属互化物的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则晶胞边长
,则晶胞边长![]() =________nm;
=________nm;
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
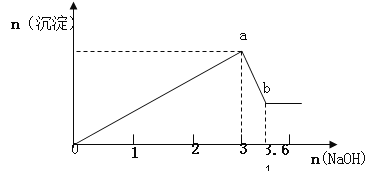
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为_____ ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。在3.84gCu中加入100mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度___、___(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是( )
A.Na2CO3比NaHCO3热稳定性强
B.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
C.相同温度下,Na2CO3的溶解度小于NaHCO3
D.物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3溶液的小
查看答案和解析>>
科目:高中化学 来源: 题型:
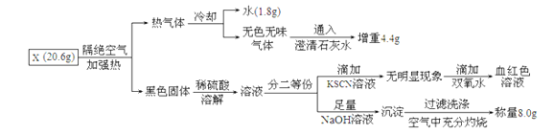
【题目】有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如图实验:
请回答:
(1)X的化学式____。
(2)X隔绝空气加热的化学反应方程式为:___。
(3)用化学方程式表示在空气中变黄的原因____。
(4)写出检验溶液A中存在的金属阳离子的实验方法:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量各为0.1mol钠、镁、铝单质,分别投入足量盐酸溶液中,生成相同条件下氢气的体积比为___。
(2)物质的量各为0.2mol的铝、铁、锌,分别与100ml1mol/L的硫酸溶液反应,生成相同条件下氢气的体积比为___。
(3)等质量的两份铝分别与足量的盐酸溶液和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】iCo2S4@g-C3N4-CNT是一类很有发展前途的化合物电催化剂。回答下列问题:
(1)基态Co2+的价层电子排布图(轨道表达式)为_________;基态S原子电子占据最高能级的电子云轮廓图为______________形。
(2)g-C3N4(结构片段如图1,环上化学键与苯环类似)可由三聚氰胺(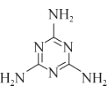 )与(NH4)2SO4共热制得。
)与(NH4)2SO4共热制得。
①g-C3N4分子中环上的氮原子、碳原子杂化方式依次为________、_____。
②SO42—的空间构型为 __________________。
③三聚氰胺分子中含σ键 ______个,它不溶于冷水,溶于热水,其主要原因是 ______________________。
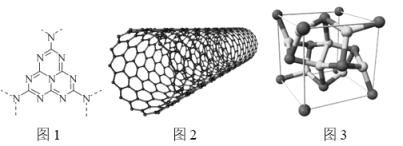
(3)碳纳米管(CNT,结构如图2)具有良好的导电性,其原因是______________。
(4)CoS2具有 AB2型立方结构(如图3),晶胞参数为553.4pm。设NA为阿伏加德罗常数的值,则晶体的密度为________________ gcm—3(列出计算式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
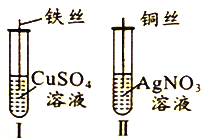
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com