
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.48g 正丁烷和 10g 异丁烷的混合物中共价键数目为 13NA
B.标准状况下,22.4LCl2 与水充分反应,转移电子数为 NA
C.标准状况下,1L 液态水中含有的H+数为 10ˉ7NA
D.2.0g D2O 和 H218O 的混合物中含有的质子数和中子数之和为 1.8NA
【答案】A
【解析】
A.丁烷分子中10个C-H键,3个C-C键,48g 正丁烷和 10g 异丁烷的混合物中共价键数目为![]() =13NA,故A正确;
=13NA,故A正确;
B.标准状况下,氯气与水的反应是可逆反应,22.4LCl2 与水充分反应,转移电子数少于 NA,故B错误;
C.标准状况下是0℃,常温下,1L 液态水中含有的H+数为 10ˉ7NA,而水的电离过程是吸热过程,降温,电离程度减小,所以标况下,电离出的氢离子数目小于10-7NA,故C错误;
D.D2O 和 H218O质子数和中子数之和均为20, 2.0g D2O 和 H218O 的混合物(为0.1mol)中含有的质子数和中子数之和为 2.0NA,故D错误;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。在3.84gCu中加入100mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度___、___(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】iCo2S4@g-C3N4-CNT是一类很有发展前途的化合物电催化剂。回答下列问题:
(1)基态Co2+的价层电子排布图(轨道表达式)为_________;基态S原子电子占据最高能级的电子云轮廓图为______________形。
(2)g-C3N4(结构片段如图1,环上化学键与苯环类似)可由三聚氰胺(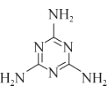 )与(NH4)2SO4共热制得。
)与(NH4)2SO4共热制得。
①g-C3N4分子中环上的氮原子、碳原子杂化方式依次为________、_____。
②SO42—的空间构型为 __________________。
③三聚氰胺分子中含σ键 ______个,它不溶于冷水,溶于热水,其主要原因是 ______________________。
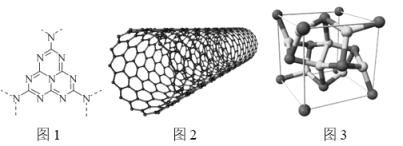
(3)碳纳米管(CNT,结构如图2)具有良好的导电性,其原因是______________。
(4)CoS2具有 AB2型立方结构(如图3),晶胞参数为553.4pm。设NA为阿伏加德罗常数的值,则晶体的密度为________________ gcm—3(列出计算式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为:Fe3++Cr2+![]() Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是

A. 电池充电时,b极的电极反应式为:Cr3++e-=Cr2+
B. 电池放电时,b极的电极反应式为:Fe2+-e-=Fe3+
C. 电池放电时,Cl-从b极穿过选择性透过膜移向a极
D. 电池放电时,电路中每通过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体样品可能含有Cu、SiO2、Fe2O3、Na2CO3、KAl(SO4)2、KNO3 中的若干种。为确定其组成,实验过程及产物如下:
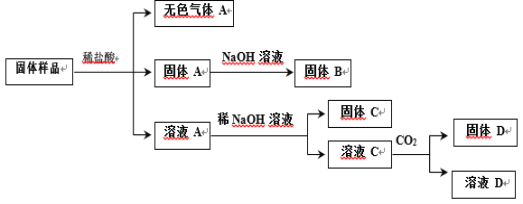
已知:①所用试剂均过量;②固体 B 的质量小于固体 A。下列说法正确的是
A.无色气体一定是纯净物
B.固体样品中一定有 Cu、Fe2O3、SiO2、Na2CO3
C.向溶液 A 加入足量浓氨水所得固体质量可能与固体 C 质量相等
D.向溶液 C 中通入 CO2 可改为进行焰色反应(透过蓝色钴玻璃片),不影响实验结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
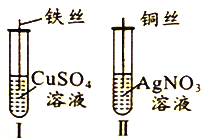
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
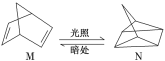
ΔH=+88.6 kJ/mol则M、N相比,较稳定的是_____________。
(2)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+12O2(g)=CO2(g)+2H2(g) ΔH=-a kJ/mol,则a________238.6(填“>”“<”或“=”)。
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:__________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ/mol,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铱(Ir)和锇(Os)属于铂族金属,与金、银合称贵重金属,可以用于电气、精密仪表、催化剂等领域。铱锇矿的主要成分有Ir、Os、Ir2O3、OsO2,还含有CuO和SiO2等杂质,从铱锇矿中提取铱(Ir)和锇(Os)的流程如下:
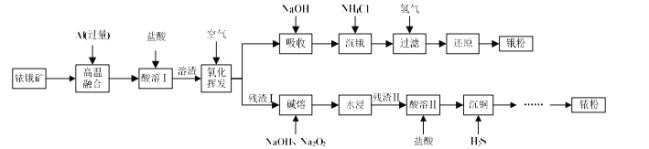
已知:①高温融合发生反应的原理类似于铝热反应。
②四氧化锇(OsO4)的熔点为41℃,易挥发、有恶臭和剧毒。
③四氨合二氧氯化锇([OsO2(NH3)4]Cl2)呈浅黄色,难溶于有机物,微溶于水,能水解。
回答下列问题:
(1)“酸溶I”的目的是_____________________________________;酸溶I后溶渣的主要成分除Ir、Os外,还有_______ (填化学式)。
(2)“氧化挥发”是将溶渣置于300~800 ℃的管式炉内,通入空气氧化。用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为 __________________;当吸收液质量增加59.5 g时,反应转移电子的数目为 ______。
(3)“沉锇”时, NH4Cl与Na2OsO4发生反应Na2OsO4 + 4NH4Cl=[OsO2(NH3)4]Cl2↓ + 2NaCl + 2H2O,该过程中NH4Cl需过量,目的是_____________________________ ;生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的原因是____。
(4)“残渣I”的主要成分为Ir、CuO和SiO2。“碱熔”时,Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为 _______________________。
(5) “沉铜” 过程中,当通入H2S 达到饱和时测得溶液的pH=1,此时溶液中c(Cu2+)为____。[已知:25 ℃下,H2S溶于水形成饱和溶液时,c(H2S)=0.1mol/L;H2S的电离常数![]() ,
,![]() ;
;![]() ]
]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com