
【题目】2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。
(1)N元素原子核外电子云的形状有____________种;基态铜原子的价电子排布式为_______________,金属铜的晶体中,铜原子的堆积方式为________________。
(2)N和O中第一电离能较大的元素是___________;SO42-的空间构型是_______________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为______________,H2O2难溶于CCl4,其原因为__________________。
(4)PM2.5富含大量的有毒、有害物质,如NO、CH3COOONO2(PAN)等。1molPAN中含σ键数目为__________;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________________。
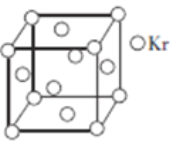
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相邻的Kr原子有m个,晶胞中所含Kr原子有n个,则m/n=________________。
【答案】 2 3d104s1 面心立方堆积 N 正四面体 sp3 H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中 6.02×1024(或10NA) 6 3
【解析】(1)N元素原子核电荷数为7,核外电子排布为1s22s22p3,因此核外电子云的形状有2种;
基态铜原子核电荷数为29,基态铜原子的价电子排布式为3d104s1 ;金属铜的晶体中,铜原子的堆积方式为面心立方堆积;正确答案:2; 3d104s1 ; 面心立方堆积。
(2)同周期中从左到右,元素的第一电离能(除ⅡA族、ⅤA族反常外)逐渐增大,N为ⅤA族元素,2p3为半充满状态,因此性质较稳定,所以N第一电离能大于O;SO42-离子中存在的σ键个数为4,中心硫原子没有孤电子对,因此SO42-空间构型是正四面体;正确答案:N ;正四面体。
(3)H2O中心原子(氧原子)的价层电子对数为4,故为sp3 杂化,H2O2看作羟基取代了H2O分子中一个H原子,H2O2中O原子应为sp3杂化;H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中;正确答案:sp3 ;H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中。
(4)一个单键就是一个σ键,一个双键中含有一个σ键,一个π键,![]() 中共有11个共价键,所以1molPAN中含有的σ键数目为10NA或6.02×1024;配位体位于方括号中,由1个NO和5个H2O分子构成;中心离子为Fe2+,配位数为6;正确答案:6.02×1024(或10NA) ;6。
中共有11个共价键,所以1molPAN中含有的σ键数目为10NA或6.02×1024;配位体位于方括号中,由1个NO和5个H2O分子构成;中心离子为Fe2+,配位数为6;正确答案:6.02×1024(或10NA) ;6。
(5)Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之相邻的Kr原子处于面心,每个顶点Kr原子为8个晶胞共有,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有![]() ,晶胞中含Kr原子为
,晶胞中含Kr原子为![]() ,则
,则![]() ;正确答案:3。
;正确答案:3。


科目:高中化学 来源: 题型:
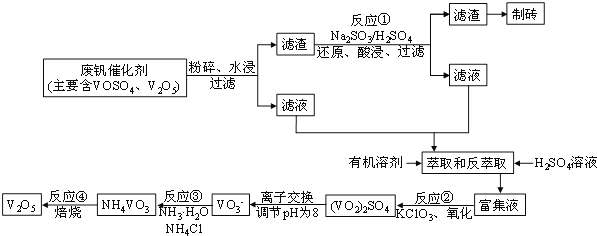
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。该工艺的主要流程如图所示:
已知部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为____。
(2)滤液中含钒的主要成分________(写化学式)。反应①的离子方程式___________________。
(3)萃取和反萃取过程中所需的主要玻璃仪器为_____________。若反萃取使用硫酸用量过大,进一步处理会增加_______(填化学式)的用量,造成成本增大。
(4)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式___________________。“沉淀”过程中,沉钒率受温度、氯化铵系数(NH4Cl的质量与调节pH之后的料液中VO3-的质量比)等的影响,其中温度与沉钒率的关系如图所示,温度高于80℃沉钒率降低的可能原因是___________________________。

(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,③中加入氨水,调节溶液的最佳pH值为____。若矾沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____。(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(6)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5)。取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1molL-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行者广泛研究。回答:
(1)某课题组实现了在常湿常压下,以氮气和液态水为原料制备氨气同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(s) | H20(1) |
△H/ kJ·mo1-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为催化剂,据到示判断,负极反应的催化剂为___(填“Q”或“R”);正极的电极反应式为_______________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+ 6H2O(g)△H=-126kJ/mol
2N2(g)+ 6H2O(g)△H=-126kJ/mol
将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
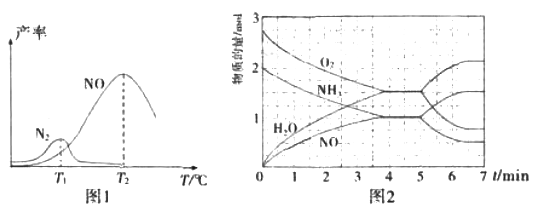
①催化氧化步骤中,最适宜的温度为____(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____。
③高于T2℃时,NO的产率降低的可能原因为_____(填选项字母)
A.催化剂活性降低 B.平衡常数减小 C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充入2molNH3和2.75mo1O2,发生反应I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。T2℃时,该反应的平衡常数K=_____;5min时,改变了某一外界条件,所改变的条件可能为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 ,在一定条件下可以相互转化。下列说法正确的是
,在一定条件下可以相互转化。下列说法正确的是
A. ①分子中的所有原子可以处于同一平面内
B. ①的同分异构体只有②和③
C. ①②③均能与H2发生加成反应
D. ③的一氯取代物和二氯取代物均只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组用下图装置探究条件对Na2S2O3溶液与稀H2SO4反应速率的影响。请回答有关问题。
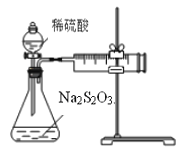
(1)写出该反应的离子方程式_______________________________________________________。
(2)连接好仪器后,开始实验前还需进行的操作是_____________________________________。
(3)现探究浓度对该反应速率(单位mL/min)的影响。
①应测定的实验数据为_____________。
②该实验实施过程中测定的气体体积比实际值偏小的一个重要原因是:____________________。
(4)若该小组同学设计了如下四组实验,
实验 | 反应温度 /℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | |||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | |||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 | |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 | |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 | |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 | |
① 实验数据体现了反应物__________(填化学式)的浓度及__________条件对反应速率的影响。
② 预测反应速率最快的一组实验序号为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应速率的说法中,错误的是( )
A.反应速率可衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.增大反应物浓度、提高反应物温度都能增大反应速率
D.因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol/L) | 6 | 3 | 2 | 2 |
c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B![]() 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com