
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与 NaOH 完全反应,消耗 NaOH 物质的量:③>④
B.分别加水稀释 10 倍,四种溶液的 pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中 c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
D.在③溶液中:c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-)
【答案】D
【解析】
A.醋酸溶液属于弱酸溶液,盐酸属于强酸溶液,pH=4的醋酸溶液和盐酸溶质物质的量浓度:醋酸溶液>盐酸,则相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④,A正确;
B.由于加水稀释促进NH3·H2O的电离,pH=10的氨水加水稀释10倍后溶液的pH:9<pH<10,pH=10的氢氧化钠溶液加水稀释10倍后溶液的pH=9,由于加水稀释促进CH3COOH的电离,pH=4的醋酸溶液加水稀释10倍后溶液的pH:4<pH<5,pH=4的盐酸加水稀释10倍后溶液的pH=5,则分别加水稀释10倍,四种溶液的 pH:①>②>④>③,B正确;
C.pH=10的氨水中c(OH-)=10-4mol/L,pH=4的盐酸中c(H+)=10-4mol/L,由于氨水为弱碱溶液,盐酸为强酸溶液,则两者等体积混合充分反应后得到NH4Cl和过量氨水的混合液,即氨水过量,溶液呈碱性,则c(OH-)>c(H+),混合后溶液中的电荷守恒为c(![]() )+c(H+)= c(Cl-)+c(OH-),则c(
)+c(H+)= c(Cl-)+c(OH-),则c(![]() )>c(Cl-),由于弱电解质的电离是微弱的,故所得溶液中 c(
)>c(Cl-),由于弱电解质的电离是微弱的,故所得溶液中 c(![]() )>c(Cl-)>c(OH-)>c(H+),C正确;
)>c(Cl-)>c(OH-)>c(H+),C正确;
D.pH=4的醋酸溶液中的电荷守恒为c(H+)=c(CH3COO-)+c(OH-),D错误;
答案选D。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】由乙烷和乙烯都能制得一氯乙烷。
(1)由乙烷制一氯乙烷的化学方程式为____________,反应类型为______________。
(2)在催化剂作用下,由乙烯制一氯乙烷的化学方程式为____________,反应类型为______________。
(3)以上两种方法中_________[填“(1)”或“(2)”]更适合用来制取一氯乙烷,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学习过氧化钠与水的反应时,向滴有酚酞的水中加入过氧化钠,发现溶液先变红后褪色,对此产生兴趣并进行研究。
(1)写出Na2O2与水反应的化学方程式:______。
(2)甲同学查阅资料:红色褪去的原因是H2O2在碱性条件下氧化了酚酞。
①甲同学通过实验证实了Na2O2与水反应所得溶液中有较多的H2O2:取少量反应所得溶液,加入试剂______(填化学式),有气体产生。
②甲同学利用3% H2O2溶液、酚酞试液、1mol·L-1 NaOH溶液,证实了碱性条件是必需的。
操作 | 现象 | |
实验1 | 向2mL 3%H2O2溶液中加入3滴酚酞试液,振荡,静置5min,再加入5滴1mol·L-1 NaOH溶液 | 观察到______。 |
(3)为了更深入地了解该原理,甲同学继续查阅资料,发现H2O2溶液中相关微粒的物质的量分数X(i)与溶液pH的关系如图所示。
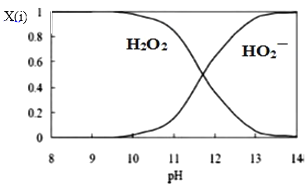
据此,甲同学设计实验2继续研究:
操作 | 现象 | |
实验2 | i.配制20mL 3%H2O2与NaOH的混合溶液,调节pH分别为10~14。 ii.滴入3滴酚酞试液,搅拌后静置,记录酚酞完全褪色的时间 | 得到如图所示实验结果:
|
甲同学由此提出假设I:溶液褪色的主要原因是酚酞被HO![]() 氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
(4)乙同学查阅资料,发现酚酞(以H2L表示)在不同pH条件下存在多种结构之间的变化:
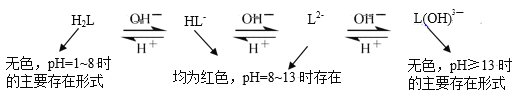
由此提出,甲同学实验2中pH13时红色褪去的原因还存在假设II:_____。
(5)针对假设I、II,小组同学设计了如下实验:
试剂加入顺序 | 现象 | |
实验3 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入3滴酚酞试液 | 溶液变红,然后褪色 |
iii.搅拌、静置后加入2mL 30% H2O2溶液 | _____ | |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 溶液变红,然后褪色 | |
实验4 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入2mL 30% H2O2溶液 iii.搅拌、静置后加入3滴酚酞试液 | 溶液变红,然后褪色 |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 不变红 |
①与L2-和HL-相比较,L(OH)![]() 比前两者更_____被氧化(填“难”或“易”)。
比前两者更_____被氧化(填“难”或“易”)。
②实验3中调节pH至12,溶液变红然后褪色的原因是:_____。
③根据实验得出结论:甲同学实验2中pH13时红色褪去的主要原因是_____(填“假设I”或“假设II”),请依据实验现象阐述理由:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如下:

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水。在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。高锰酸钾具有强氧化性。高锰酸钾(K2FeO4)与水作用产生Fe(OH)3。
(1)检验废液中含有Fe2+选用的试剂是________(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是_________(填化学式),加入时发生反应的离子方程式为__________。
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是_________和__________。
(3)“氧化”过程反应的离子方程式为__________。
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和________,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用_________溶解,然后________。
(5)用回收的铜为原料可制得粗制CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4·5H2O的晶体。
已知:室温时一些物质的Kaq如下表:
化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
已知溶液中的离子浓度小于1×10-6mol·L-1时就认定沉淀完全。
加双氧水的目的是__________;若溶液中CuSO4的浓度为3.0mol·L-1,通过计算说明此方法可除去粗制CuSO4·5H2O晶体中FeSO4·7H2O的理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4 溶液显酸性,关于 NaHC2O4 溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4)
)+c(H2C2O4)
C.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.c(H+)+c(H2C2O4)=c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
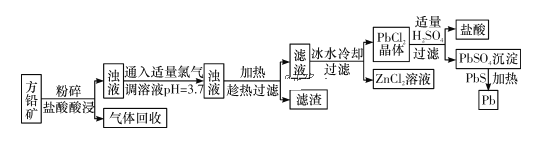
【题目】方铅矿(主要成分是PbS,含少量ZnS、Fe、SiO2)是提炼铅及其化合物的重要矿物,其工艺流程如下所示:
请回答下列问题:
(1)流程中“趁热”过滤的原因是_____,滤渣的主要成分是____。
(2)该工艺流程中可循环利用的物质是_____。
(3)PbSO4与PbS在加热条件下发生反应的化学方程式为_____。
(4)将PbO高温焙烧可制得铅丹(Pb3O4),铅丹中含有杂质PbO。PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,提纯时发生反应的离子方程式为____。
(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,电解过程中阳极的电极反应式为___;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9 g时(忽略副反应),理论上蓄电池负极增重____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验:

下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、![]() 和
和![]() 一定存在于溶液X中
一定存在于溶液X中
D.![]() 和
和![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1 mol O2(g)中的化学键需要吸收498 kJ的能量。根据能量变化示意图,下列说法不正确的是
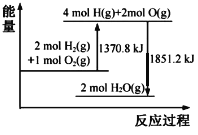
A.2H2(g)+O2(g)=2H2O(l) △H=-480.4 kJ·molˉ1
B.H2O(g)=H2(g)+![]() O2(g) △H=240.2 kJ·molˉ1
O2(g) △H=240.2 kJ·molˉ1
C.拆开1 mol H2(g)中的化学键需要吸收436.4 kJ的能量
D.H2(g)和O2(g)形成H2O(g)中的1 mol H-O键放出462.8 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物、反应条件已略去):

(1)常温下,用惰性电极电解M溶液(足量)发生反应的离子方程式为__________,电解一段时间后,让溶液复原的方法为_____ ,若M溶液为0.5 L,电解一段时间后,两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为_____(忽略溶液的体积变化)。
(2)若A是一种常见的难溶于水的酸性氧化物,可用于制造玻璃,则E溶液的俗称是_______。
(3)若A是CO2气体,将一定量的A通入B溶液,得到溶液W,再向溶液W中滴入盐酸,相关量如图所示,则溶液W中的溶质及其物质的量分别为_____、_____。

(4)若A是一种化肥。A和B反应可生成气体E,E与D相遇产生白烟,工业上可利用E与D的反应检查输送D的管道是否泄漏,是因为E与D可发生反应:_________(写化学方程式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com