
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )
| A.在任何溶液中,c(Ca2+)、c(SO42—)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:单选题
常温下向四份0.1 mol·L-1的醋酸钠溶液中分别加入少量冰醋酸、硫酸氢钠固体、醋酸钠固体、氢氧化钠固体(忽略溶液体积及温度变化),则溶液中c(Ac-)/c(Na+)变化正确的是
| A.增大、增大、不变、减小 |
| B.增大、减小、增大、减小 |
| C.减小、增大、增大、减小 |
| D.增大、减小、不变、减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,用 0.01 mol·L-1NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如图。下列说法正确的是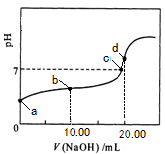
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的
CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A.若pH>7,则一定是c1V1=c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是 ( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度。下列有关叙述正确的是 ( )
A.HY-水解方程式为:HY-+ H2O H3O++ Y2- H3O++ Y2- |
| B.在该盐的溶液中离子浓度大小关系为:c(Na+) >c(Y2-) >c(HY-) >c(OH-) >c(H+) |
C.H2Y的电离方程式为:H2Y+H2O HY-+H3O+ HY-+H3O+ |
| D.在该盐的溶液中:c(Na+) >c(HY-) >c(Y2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
水的电离平衡曲线如图所示,下列说法不正确的是 ( )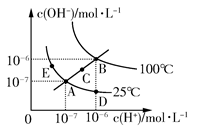
| A.图中五点KW间的关系:B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A.将溶液稀释到原体积的 10倍 |
| B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 |
| D.提高溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关水的电离平衡的说法正确的是( )
| A.水的离子积通常用KW来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大 |
| B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离 |
| C.盐溶于水对水的电离平衡均没有影响 |
| D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com