
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
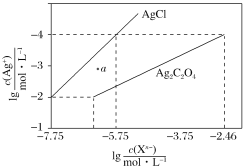
A.Ksp(Ag2C2O4)=10-7
B.a点表示的是AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)=0.1mol·L-1的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
【答案】D
【解析】
A.Ksp(Ag2C2O4)=c2(Ag+)·c(C2O![]() )=(10-4)2×(10-2.46)=10-10.46,故A错误;
)=(10-4)2×(10-2.46)=10-10.46,故A错误;
B.在a点,c(Ag+)大于平衡浓度,故a点的浓度积Qc(AgCl)>Ksp(AgCl),故为氯化银的过饱和溶液,将有沉淀析出,故B错误;
C.根据图像可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小,故向c(Cl-)=c(C2O![]() )的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C错误;
)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C错误;
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42- (aq)的平衡常数K=
2AgCl(s)+C2O42- (aq)的平衡常数K=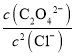 ,此时溶液中的c(Ag+)相同,故有:K=
,此时溶液中的c(Ag+)相同,故有:K= =
=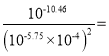 109.04,故D正确;
109.04,故D正确;
选D。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为![]() 下列关于该电池的说法不正确的是( )
下列关于该电池的说法不正确的是( )
A.充电时,若转移![]() ,石墨(
,石墨(![]() )电极将增重
)电极将增重![]()
B.充电时,阳极的电极反应式为![]()
C.放电时,![]() 在电解质中由负极向正极迁移
在电解质中由负极向正极迁移
D.放电时,负极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物在工农业生产中具有重要地位。请按要求回答下列问题。
Ⅰ.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用葡萄糖还原新制的Cu(OH)2(NaOH过量)制备Cu2O |
方法b | 用肼(N2H4)加热还原新制的Cu(OH)2制备Cu2O,同时放出N2 |
方法c | 用炭粉在1000℃以上还原CuO制备Cu2O,同时放出CO |
(1)写出方法a的化学方程式:__。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) △H=-169kJ·mol﹣1
O2(g)=Cu2O(s) △H=-169kJ·mol﹣1
②C(s)+![]() O2(g)=CO(g) △H=-110.5kJ·mol﹣1
O2(g)=CO(g) △H=-110.5kJ·mol﹣1
③CuO(s)=Cu(s)+![]() O2(g) △H=+157kJ·mol﹣1
O2(g) △H=+157kJ·mol﹣1
写出方法c反应的热化学方程式:__。
(3)在相同的密闭容器中,用上表方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)![]() 2H2(g)+O2(g) △H>0。水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气的浓度随时间t变化如下表所示:
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
i | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 | ii | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
iii | T2 | 0.100 | 0.0960 | 0.0930 | 0.0900 | 0.0900 | 0.0900 |
对比上述实验数据,可获得的结论:
①催化剂的催化效率:实验i___实验ii(填“>”“<”“=”,下同)。
②T1__T2。
Ⅱ.在2L的恒温密闭容器中通入5molO2并加入足量Cu2S发生反应:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H1=-271.4kJ/mol,
反应过程中某气体的体积分数随时间变化如图所示。
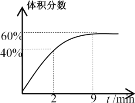
(4)反应前2min平均反应速率v(SO2)=__;该温度下反应的平衡常数K=__。
若保持温度不变向平衡体系中再通入1molO2,达到新平衡后氧气的体积分数__(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
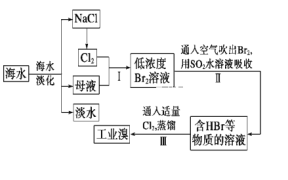
(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
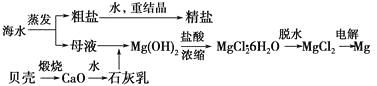
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于我国煤储藏量相对比石油和天然气丰富,能源消费以煤为主。将原煤作为燃料燃烧,既严重污染环境,效率又不高,因而国家大力提倡煤的综合利用。实施“煤变油”,其原理之一是先将煤与水蒸气制得水煤气(一氧化碳和氢气),再催化合成甲醇或烃类等液态能源。
(1)用一氧化碳和氢气合成甲醇的化学方程式是______________________________________。
(2)用一氧化碳和氢气合成烃(CnHm)的化学方程式是__________________________。
(3)气化和液化的优点是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用36.5%、密度为1.19g/cm3的浓盐酸配制0.1mol/L的稀盐酸500mL,请回答:
(1)用量筒量取所需浓盐酸的体积为___mL。
(2)实验配制稀盐酸,所用到的玻璃仪器:___、___、___、___、量筒。
(3)如果在配制过程中,第一次加水量太少,搅拌时间较长,导致配制溶液的浓度___(偏大,偏小或不影响)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com