
【题目】江苏正在建设世界最大的海上风电场,防腐蚀是海上风电的突出问题,下列说法正确的是
A. 海水的pH一般在8.0~8.5,对风电钢铁支架的腐蚀主要是析氢腐蚀
B. 腐蚀总反应为4Fe+3O2+2xH2O==2[Fe2O3·xH2O](铁锈)的△H<0,△S<0
C. 钢部件镀锌前,可用碱液洗去表面的铁锈
D. 热喷涂锌铝合金,可以减缓管道的腐蚀
【答案】BD
【解析】分析:A,海水的pH一般在8.0~8.5,对钢铁支架的腐蚀主要是吸氧腐蚀;B项,腐蚀的总反应为4Fe+3O2+2xH2O=2[Fe2O3·xH2O],该反应为放热反应,ΔS![]() 0;C项,碱液与铁锈不反应;D项,锌铝合金比Fe活泼,锌铝合金为负极,钢铁为正极被保护,减缓管道的腐蚀。
0;C项,碱液与铁锈不反应;D项,锌铝合金比Fe活泼,锌铝合金为负极,钢铁为正极被保护,减缓管道的腐蚀。
详解:A项,海水的pH一般在8.0~8.5,海水呈弱碱性,对钢铁支架的腐蚀主要是吸氧腐蚀,A项错误;B项,钢铁发生吸氧腐蚀的电极反应式为:负极电极反应式为Fe-2e-=Fe2+、正极电极反应式为O2+2H2O+4e-=4OH-,电池总反应为2Fe+O2+2H2O=2Fe(OH)2,接着发生的反应有4Fe(OH)2+O2+2H2O=4Fe(OH)3、2Fe(OH)3=Fe2O3+3H2O,腐蚀的总反应为4Fe+3O2+2xH2O=2[Fe2O3·xH2O],该反应为放热反应,ΔS![]() 0,B项正确;C项,铁锈的主要成分为Fe2O3·xH2O,碱液与铁锈不反应,不能洗去钢部件表面的铁锈,C项错误;D项,锌铝合金比Fe活泼,锌铝合金为负极,钢铁为正极被保护,减缓管道的腐蚀,此保护法称为牺牲阳极的阴极保护法,D项正确;答案选BD。
0,B项正确;C项,铁锈的主要成分为Fe2O3·xH2O,碱液与铁锈不反应,不能洗去钢部件表面的铁锈,C项错误;D项,锌铝合金比Fe活泼,锌铝合金为负极,钢铁为正极被保护,减缓管道的腐蚀,此保护法称为牺牲阳极的阴极保护法,D项正确;答案选BD。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:

①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. C![]() CO2
CO2![]() CO
CO![]() CO2
CO2
B. Na2SO3![]() SO2
SO2![]() H2SO3
H2SO3
C. CaCO3![]() CaCl2
CaCl2![]() Ca(ClO)2
Ca(ClO)2
D. N2![]() NO
NO![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
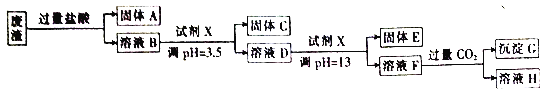
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阳离子 | Fe3+ | A13+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol/L。
请回答下列问题:
(1)固体C为________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是________(填“氨水”或“氢氧化钠”),其理由是________ 。
(3)向溶液D中滴人试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、________、________。
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________。
(5)写出溶液F→溶液H的离子方程式: ________ 。
(6)Ksp[Mg(OH)2]= ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AJ几种有机物的分子球棍模型或结构简式如图所示,据此回答下列问题:

(1)不能够发生加成反应的烃有__________种,属于芳香族化合物的有_____种。
(2)与E互为同系物的是__________,与G互为同分异构体的是__________。(填字母)
(3)在催化剂作用下,D能与水反应生成乙醛,写出该反应的化学方程式:___________。
(4)上述有机物中有一种能与NaOH溶液反应,请写出该反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸可以干燥氢气__________
②浓硫酸使木条变黑__________
③热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(i)配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
(ii)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL(保留一位小数),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸在下列反应中,既表现出氧化性,又表现出酸性的是
①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
③2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O
④Fe2O3+3H2SO4Fe2(SO4)3+3H2O
A. ①② B. ②③
C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=7,则强碱与强酸的体积比是( )
A. 11∶1B. 10∶1C. 1∶11D. 1∶10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com