
����Ŀ����1����14.2g��ˮ���������Ƴ�500 mL��Һ�������ʵ���Ũ��Ϊ______mol/L��
��2����������Һʱ������ͼ��ʾ��Ũ��_______��ƫ�ߣ�ƫ�ͣ����䣩��

��3������������Һ(��ȷ����)��ȡ��10 mL������10 mL��Һ�����ʵ���Ũ��Ϊ______mol/L�������ʵ�����Ϊ_______g��
��4����������10 mL��Һ��ˮϡ�͵�100 mL��������Һ��Na+�����ʵ���Ũ��Ϊ_________mol/L������ϡ�ͺ���Һ�е�![]() ȫ������������������Ҫ����0.1 mol/L��BaCl2��Һ___________mL��
ȫ������������������Ҫ����0.1 mol/L��BaCl2��Һ___________mL��
���𰸡�0.2 ƫ�� 0.2 0.284 0.04 20
��������
��1��14.2g��ˮ�����Ƶ����ʵ���Ϊ��![]() ����0.1mol��ˮ���������Ƴ�500 mL��Һ�������ʵ���Ũ��Ϊ
����0.1mol��ˮ���������Ƴ�500 mL��Һ�������ʵ���Ũ��Ϊ![]() ��
��
��2�����ӻᵼ��������Һ���ƫ�����յ���Ũ��ƫ�ͣ�
��3����Һ���о�һ�ԣ���˴�������Һ(��ȷ����)��ȡ��10 mL������10 mL��Һ�����ʵ���Ũ��Ϊ0.2mol/L�������ʵ�����Ϊ0.01L��0.2mol/L��142g/mol=0.284g��
��4��ԭ��Һ��Na+�����ʵ���Ũ��Ϊ0.4mol/L����ˮϡ�͵�100 mL����Һ�������10������Na+�����ʵ���Ũ�ȼ�С10������������Һ��Na+�����ʵ���Ũ��Ϊ0.04mol/L��10mL����Һ�к�![]() �����ʵ���Ϊ0.01L��0.2mol/L=0.002mol������ϡ�ͺ���Һ�е�
�����ʵ���Ϊ0.01L��0.2mol/L=0.002mol������ϡ�ͺ���Һ�е�![]() ȫ������������������Ҫ����0.002molBa2+������0.1 mol/L��BaCl2��Һ���Ϊ
ȫ������������������Ҫ����0.002molBa2+������0.1 mol/L��BaCl2��Һ���Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mL���͵�H2S��Һ��ͨ��SO2����(�����������ɱ�״��)��������Ӧ��2H2S+SO2=3S��+2H2O�������ҺpH��ͨ��SO2�Ĺ�ϵ��ͼ��ʾ�������й�˵��������ǣ� ��
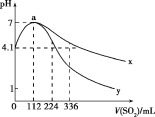
A.a��ˮ�ĵ���̶����
B.���¶���H2S��Ka1��10-7.2
C.����y��������ͨ��SO2�������ҺpH�ı仯
D.a��֮����SO2�����ͨ�룬![]() ��ֵʼ�ռ�С
��ֵʼ�ռ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���![]() ��˵����ȷ����
��˵����ȷ����
A. ����ԭ�ӿ��ܶ���ͬһƽ���� B. ���ֻ������9��̼ԭ����ͬһƽ��
C. ��7��̼ԭ�ӿ�����ͬһֱ�� D. ֻ������5��̼ԭ����ͬһֱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽�����������ķֽ�������������װ����ͼ��ʾ��װ��a�У���K1��K2������ͨ��N2�����ȡ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ������˵������ȷ����( )
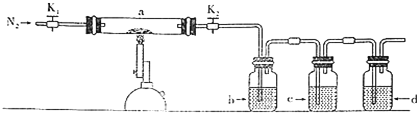
A.װ��d֮����Ҫ����β������װ��
B.װ��b�е��Լ�ΪBa(NO3)2��Һ����Ӧ���а�ɫ��������
C.װ��c�е��Լ�Ϊ����KMnO4��Һ�������dz�ȥ��������е�SO2
D.�ֽ�������������SO3��SO2��Ӧ���ȼ���SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������3���Ȼ�ѧ����ʽ��
H2(g)+![]() O2(g)=H2O(g)����H1= -a kJ��mol-1��
O2(g)=H2O(g)����H1= -a kJ��mol-1��
H2(g)+![]() O2(g)=H2O(l)����H2= -b kJ��mol-1��
O2(g)=H2O(l)����H2= -b kJ��mol-1��
2H2(g)+O2(g)=2H2O(l)����H3= -c kJ��mol-1��
�����±����е�ԭ�����Ƶ���������۵���(����)
ѡ�� | ԭ�� | ���� |
A | H2��ȼ���Ƿ��ȷ�Ӧ | a��b��c�������� |
B | �ٺ͢������ʵĻ�ѧ����������ͬ | a=b |
C | �ٺ͢���H2O��״̬��ͬ����ѧ��������ͬ | a��c�������κι�ϵ |
D | �۵Ļ�ѧ�������Ǣڵ�2�� | ��H2����H3 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ���й���������ȷ����
��� | �� | �� | �� | �� |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A. �ۢ��зֱ���������Ĵ����ƾ��������Һ��pH������
B. �ڢ�����Һ�������ϣ�������Һ��c(H��)��c(OH��)
C. �ֱ��ˮϡ��10����������Һ��pH�٣��ڣ��ܣ���
D. V1L����V2L����Һ��Ϻ�����Ϻ���ҺpH��7����V1��V2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���о���������Al2O3�ĺ������������ϵ�֪�����������Ҫ�ɷ���Al2O3��������Fe2O3��SiO2�ȡ�������������ȡAl2O3�Ĺ������£�

��1����ȡǰ����������������Ŀ����__________��
��2������B����Ҫ��;��________________��д��һ�����ɣ���
��3�������������������м��������ռ���Һ����ַ�Ӧ��������Ӧ�����ӷ���ʽ�У� _____________������дһ������
��4���������м�����������Ŀ����____________________��ʵ��������200mL 8mol/L��������Ҫ�IJ���������__________________��
��5���ܷ�ѵ������еİ�ˮ������������__________������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������̼�ܵȲ��������Ķ��ε�ص�ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
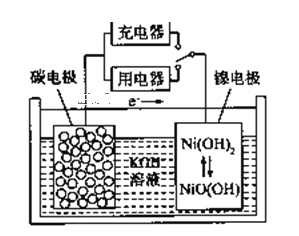
A. ���ʱ�������ĵ缫��ӦΪ��Ni(OH)2+OH-+e-=NiO(OH)+H2O
B. �ŵ�ʱ�������ĵ缫��ӦΪ��H2-2e-+2OH-=2H2O
C. �ŵ�ʱ��OH���������缫
D. ���ʱ������ص�̼�缫�����Դ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( ��
A. PH=1�Ĵ����ˮϡ�͵�ԭ�����100����ϡ�ͺ�PH=3
B. ���� pH��3�Ĵ�����Һ��pH��11��Ba(OH)2��Һ�������Ϻ���Һ������
C. ����pH��ͬ��NH4Cl��Һ��CH3COOH��Һ����ˮ���������c(H��)��ͬ
D. ij�¶��£�ˮ�����ӻ�����Ϊ1��10-12�����¶���PH=7����Һ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com