
| A.该反应中氧化剂与还原剂物质的量之比为1︰8 |
| B.若有lmol NO3— 发生还原反应,转移电子数为5mol |
| C.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
| D.若把该反应设计成原电池,负极反应为Fe2+—e— =Fe 3+ |
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
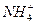 的稀溶液中,加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,离子数目基本不变的是 ( )
的稀溶液中,加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,离子数目基本不变的是 ( )| A.Al3+ | B.Fe3+ |
| C.Fe2+ | D.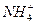 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
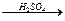 H2
H2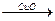 Cu
Cu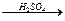 CuSO4
CuSO4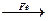 Cu
Cu| A.一样多 | B.①多 | C.②多 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 l,则溶液中H+离子同时减少 ( )
l,则溶液中H+离子同时减少 ( )| A.4.8×10-3mol | B.4.4×10-3mol |
| C.3.2×10-3mol | D.2.2×10-3mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 常温下将铜粉加入到一定量浓硝酸中 | 常温下将铁粉加入到一定量浓硝酸中 |
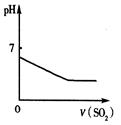 | 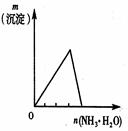 |  |  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18.4g | B.13.8g | C.8.2g | D.9.2g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.线段BD表示Fe3+物质的量的变化 |
| B.原混合溶液中FeBr2的物质的量为6mol |
| C.当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,“纳米铜”比铜片的金属性强 | B.常温下,“纳米铜”比铜片更易失电子 |
| C.常温下,“纳米铜”与铜片的还原性相同 | D.常温下,“纳米铜”比铜片的氧化性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com