
����Ŀ�������Թ�ѧ��������Ϣ�����⼼����ҽ�ơ����������������ҪӦ�ü�ֵ���ҹ���ѧ������Cs2CO3��XO2(X=Si��Ge)��H3BO3�״κϳ������ΪCsXB3O7�ķ����Թ�ѧ���塣�ش��������⣺
��1��C��O��Si����Ԫ�ص縺���ɴ�С��˳��Ϊ__����һ������I1(Si)__I1(Ge)(��>��<)��
��2����̬Geԭ�Ӻ�������Ų�ʽΪ__��SiO2��GeO2�������Ƶľ���ṹ�������۵�ϸߵ���__��
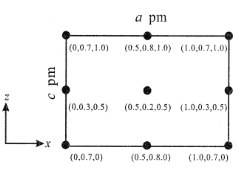
��3����ͼΪH3BO3�����Ƭ��ṹ������B���ӻ���ʽΪ__����������ˮ�б�����ˮ���ܽ�������������Ҫԭ����__��
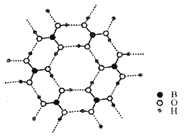
��4���Ծ�������Ϊ��λ���Ƚ���������ϵ���Ա�ʾ�����и�ԭ�ӵ�λ�ã�����ԭ�ӷ������ꡣCsSiB3O7��������ϵ(��������)����������Ϊapm��bpm�ͺ�cpm����ͼΪ��y��ͶӰ�ľ���������Csԭ�ӵķֲ�ͼ��ԭ�ӷ������ꡣ�ݴ��ƶϸþ�����Csԭ�ӵ���ĿΪ__��CsSiB3O7��Ħ������ΪMg��mol-1����NAΪ�����ӵ�������ֵ����CsSiB3O7������ܶ�Ϊ__g��cm-3(�ô���ʽ��ʾ)��
���𰸡�O>C>Si > 1s22s22p63s23p63d104s24p2(��[Ar]3d104s24p2) SiO2 sp2 ��ˮ�ƻ������ᾧ���е�������������������ˮ�γɷ��Ӽ������ʹ�ܽ������ 4 ![]() ��1030
��1030
��������
�ŵ縺�Եı仯����Ϊͬ���ڴ�������������ͬ��������������С����һ�����ܵı仯����Ϊͬ��Ԫ������������С��
��SiO2��GeO2Ϊͬ���;���ṹ����Ϊԭ�Ӿ��壬Geԭ�Ӱ뾶����Si��Si��O����С��Ge��O������SiO2���ܸ����۵���ߣ�
��Bԭ���������3�����ӣ���3����OH�γ�3�����ۼ������ɵ��ӻ���ʽ����ˮ�ƻ������ᾧ���е�������������������ˮ�γɷ��Ӽ������ʹ�ܽ������
���ȷ����ó�Cs�ĸ������ٸ��ݹ�ʽ�����ܶȡ�
�ŵ縺�Եı仯����Ϊͬ���ڴ�������������ͬ��������������С�����Ե縺��O>C>Si���ʴ�Ϊ��O>C>Si����һ�����ܵı仯����Ϊͬ��Ԫ������������С�����I1(Si)>I1(Ge)���ʴ�Ϊ��>��
��Geԭ��λ�ڵ�������IVA�壬���ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d104s24p2����[Ar]3d104s24p2�����ʴ�Ϊ��1s22s22p63s23p63d104s24p2����[Ar]3d104s24p2����SiO2��GeO2��Ϊԭ�Ӿ��壬Geԭ�Ӱ뾶����Si��Si��O����С��Ge��O������SiO2���ܸ����۵���ߣ��ʴ�Ϊ��SiO2��
��Bԭ���������3�����ӣ���3����OH�γ�3�����ۼ������Ϊsp2�ӻ����ʴ�Ϊ��sp2����ˮ�ƻ������ᾧ���е�������������������ˮ�γɷ��Ӽ������ʹ�ܽ�����ʴ�Ϊ����ˮ�ƻ������ᾧ���е�������������������ˮ�γɷ��Ӽ������ʹ�ܽ������
��ԭ�ӷ�������Ϊ��0.5��0.2��0.5����Csԭ��λ�ھ������ڣ�ԭ�ӷ�������Ϊ��0��0.3��0.5������1.0��0.3��0.5����Csԭ��λ�ھ�����yz���ϣ�ԭ�ӷ�������Ϊ��0.5��0.8��1.0������0.5��0.8��0����Csԭ��λ�ھ���xy���ϣ�ԭ�ӷ�������Ϊ��0��0.7��1.0������1.0��0.7��1.0����0��0.7��0������1.0��0.7��0����Csԭ��λ�ھ���ƽ����y������ϣ����þ�̯���ɼ���þ����й���Csԭ��4�������뾧���ܶ����㹫ʽ�ɵã�
��=![]() g��cm-3���ʴ�Ϊ��4��
g��cm-3���ʴ�Ϊ��4��![]() ��1030��
��1030��


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Է�ĩ״���ڣ��Ͱ�������������ͬ�������塣��֪��
��Sn��s���ף�+2HCl��aq��=SnCl2��aq��+H2��g�� ��H1
��Sn��s���ң�+2HCl��aq��=SnCl2��aq��+H2��g�� ��H2
��Sn��s���ң�![]() Sn��s���ף� ��H3=+2.1kJmol-1
Sn��s���ף� ��H3=+2.1kJmol-1
����˵����ȷ���ǣ� ��
A.��H1>��H2
B.���ڳ������Ի���״̬����
C.����תΪ�����ķ�Ӧ�Ƿ��ȷ�Ӧ
D.���������ڴ��ڵ���13.2��Ļ����У������лٻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĺ����ܱ������У���������Щ���������ٷ����仯ʱ������������Ӧ�� A��g��+2B��g��![]() C��g����D��g���Ѵﵽƽ��״̬�� ��
C��g����D��g���Ѵﵽƽ��״̬�� ��
�ٻ�������ѹǿ �ڻ��������ܶ� ��B�����ʵ���Ũ�� �ܻ������������ʵ���
�ݻ�������ƽ����Է������� �������������� ��C��D��Ũ��֮�ȵ��ڻ�ѧ������֮��
A.ȫ��B.�٢ۢܢ�C.�ڢۢܢ�D.�٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������С�����������ZVI���ĵ绯ѧ��ʴ����������ϩ������ˮ�����Ĺ�����ͼ��ʾ��H+��O2��NO3���ȹ�����Ĵ��ڻ�Ӱ��ˮ����Ч�������嵥λʱ����ZVI�ͷŵ��ӵ����ʵ���Ϊnt������������Ч��ʴ�ĵ��ӵ����ʵ���Ϊne������˵��������ǣ� ��

A. ��Ӧ�٢ڢۢ�������������
B. ��λʱ���ڣ�������ϩ��ȥamolClʱne=amol
C. ���ĵ缫��ӦʽΪNO3��+10H++8e��=NH4++3H2O
D. ����λ���ˮ����С����ZVI��Ͷ��������ʹnt����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��绯ѧ��ʴ��������װ������ͼ��ʾ�������й�˵����������� ��

A. dΪʯī����Ƭ��ʴ�ӿ�
B. dΪʯī��ʯī�ϵ缫��ӦΪ��O2 + 2H2O + 4e == 4OH�C
C. dΪп�飬��Ƭ���ױ���ʴ
D. dΪп�飬��Ƭ�ϵ缫��ӦΪ��2H+ + 2e == H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
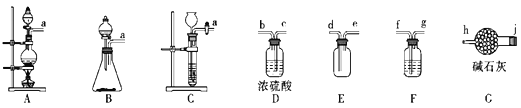
����Ŀ����������((ClNO)�Ǻϳ��л������Ҫ�м��壬ijѧϰС����ʵ������Cl2��NO�Ʊ�ClNO���ⶨ�䴿�ȣ����ʵ��װ����ͼ��ʾ��
��֪��1�����������ȷе�Ϊ��5.5�棬��ˮ�⣬C1NO+H2O=HNO2+HCl��
2����AgNO2����ˮ�����������ᣬAgNO2+HNO3=AgNO3+HNO2��
��1���Ʊ�Cl2�ķ���װ�ÿ���ѡ��__(����ĸ����)װ�ã�������Ӧ�����ӷ���ʽΪ__��
��2�����ռ�һƿ���﴿����������ѡ����ʵ�װ�ã�������˳��Ϊa��__(������������Сд��ĸ��ʾ)��
��3��ʵ���ҿ���ͼʾװ���Ʊ��������ȣ�
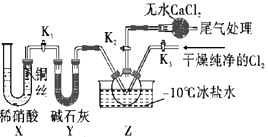
��ʵ������Xװ���Ʊ�NO����Ҫ���ŵ�Ϊ__��װ������ˮCaCl2��������__��
��4��ͨ������ʵ��ⶨC1NO��Ʒ�Ĵ��ȡ�ȡZ������Һ��mg����ˮ�����Ƴ�250mL��Һ��ȡ��25.00mL��Ʒ������ƿ�У���K2CrO4��ҺΪָʾ������cmol��L-1AgNO3����Һ�ζ����յ㣬���ı���Һ�����Ϊ20.00mL���ζ��յ��������__����������(ClNO)����������Ϊ__��(��֪��Ag2CrO4Ϊש��ɫ���壻Ksp(AgCl)=1.56��10-10��Ksp(Ag2CrO4)=1��10-2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������á������� �غ������ص�������ȷ����

A. �������صķ���ʽΪ C16H13O5
B. �������� FeCl3 ��Һ��ɫ
C. 1 mol ����������ˮ��Ӧ��������� 1 mol Br2
D. ������ H2 �����ӳɷ�Ӧ�÷����й����ŵ�������� 1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ����
A.  3������2���һ�����
3������2���һ�����
B. (CH3)3CCH2CH(C2H5)CH32��2��������4���һ�����
C. ![]() �ڼ�����
�ڼ�����
D. ![]() 2������3����Ȳ
2������3����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008��10��8�գ����ʼҿ�ѧԺ������ŵ������ѧ�������ձ���ѧ���´��ޡ�������ѧ������ɳ���������������ѧ��Ǯ�������Ա����������ڷ��ֺ��о���ɫӫ�⵰���������Ĺ��ס���������һ�ิ�ӵĺ��������ÿ�ֵ����ʶ�����㶨�ĺ�����[Լ��14%��18%�������漰�ĺ�����Ϊ����������]����ʳƷ�е����ʵĺ����ⶨ���ÿ��϶���������ⶨԭ���ǣ�
�������еĵ����ð�����ʾ����ǿ�Ⱥ�CuSO4��ŨH2SO4�����£�����һ���������������ӦʽΪ��2����NH2��+H2SO4+2H+![]() ��
��
�����������ڿ��϶�������������ã�ͨ�������ͷų�NH3���ռ���H3BO3��Һ�У����ɣ�NH4��2B4O7��
������֪Ũ�ȵ�HCl����Һ�ζ�������HCl���ĵ�����������ĺ�����Ȼ�������Ӧ�Ļ���ϵ�������õ����ʵĺ�����
��1������ԭ���ڢ����ɵ������������ﻯѧʽΪ_________��
��2������Ʒ�Ļ���ϵ��Ϊ6.38�������������ĺ���Ϊ1%�������ʵĺ�����Ϊ6.38%����������ͨ���ڵ͵��������̷��м��������谷��Melamine��������ߡ��̷��еĵ����ʺ�������������Ӥ������ʯ��
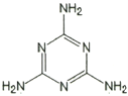
�������谷�Ľṹ��ͼ��ʾ���仯ѧʽΪ_________������������Ԫ�ص�����������Ϊ_________��
�����й��������谷��˵���У���ȷ����_________��
A�������谷��һ�ְ�ɫ�ᾧ��ĩ����ɫ��ζ�����Բ����̷ۺ��ױ�����
B�������谷����������ԭ�ӿ�����ͬһ��ƽ����
C�������谷�������ԣ����Ժ��ᷴӦ������Ӧ����
�ۼٶ��̷��е����ʺ���Ϊ16%��Ϊ�ϸ���������һ��������Ϊ500g�������ʺ���Ϊ0�ļ��̷��в���_________g�������谷�Ϳ�ʹ�̷ۡ���ꡱ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com