
【题目】下列化合物中,属于碱的是
A. MgO B. SO2 C. H2SO4 D. Ca(OH)2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】【福建省厦门市2017届高三下学期第一次质量检测理综化学试卷】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如右图所示①~④四个实验。下列推断正确的是

A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 晶体硅是一种半导体材料,常用于制造光导纤维
B. 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
C. 铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作
D. 金属钠可用于冶炼钛等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容, 4A(s)+3B(g)![]() 2C(g)+D(g)经2min,B的浓度减少0.6mol·L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol·L-1,下列说法正确的是
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 分别用B、C表示反应的速率,其关系是:3υ(B)=2υ(C)
C. 2min末的反应速率υ(B)=0.3mol·L-1·min-1
D. 气体的密度不再变化,则证明反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《木草纲目》中“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”这里的“石碱”是指( )
A. K2CO3 B. KAl(SO4)2 C. KHCO3 D. KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、写出下列化合物的名称或结构简式:
① 的名称为________________________.
的名称为________________________.
② 的名称为______________________________.
的名称为______________________________.
II、已知有机化合物X中各元素的质量分数分别为C---60%,H---13.3%,O---26.7%。
请填空:
(1)有机物X的实验式为____________。若0.1molX在足量氧气中充分燃烧需消耗氧气10.08L(标准状况),则X的分子式为________。
(2)实验表明:X能与金属钠反应产生H2。X分子的核磁共振氢谱中有4个吸收峰,且面积之比为3:2:2:1,则X分子中含有的官能团的名称为_________,X的结构简式为_____________。
(3)X有两种同分异构体Y和Z,其中Y能与金属钠反应产生H2,而Z不能。则Y、Z的结构简式分别为_______________、_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
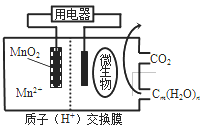
A. 正极反应式为![]()
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池负极增重9.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com