
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+ ![]() O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过分析,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______、________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
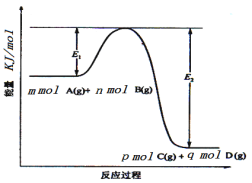
该反应ΔH=____kJ/mol(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g) K,C(s)+CO2(g)
H2 (g) +CO2 (g) K,C(s)+CO2(g)![]() 2CO(g) K1,C(s) +H2O(g)
2CO(g) K1,C(s) +H2O(g)![]() CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
【答案】< H2O(l)= H2(g)+![]() O2(g) ΔH=+286 kJ/mol H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小 K=
O2(g) ΔH=+286 kJ/mol H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小 K=![]()
【解析】
根据燃烧热的概念分析比较反应热的大小;根据盖斯定律计算反应热并书写热化学方程式;根据催化剂对反应速率的影响原理分析解答;根据平衡常数表达式进行相关计算。
(1)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,反应CH3OH(l)+ ![]() O2(g) =CO2(g)+2H2O(g) ΔH=-a kJ/mol,因H2O(l)转化为H2O(g)需要吸收热量,故a<238.6,故答案为:<;
O2(g) =CO2(g)+2H2O(g) ΔH=-a kJ/mol,因H2O(l)转化为H2O(g)需要吸收热量,故a<238.6,故答案为:<;
(2)根据系统I中反应,运用盖斯定律将3个反应相加得:H2O(l)= H2(g)+![]() O2(g) ΔH=ΔH1+ΔH3+ΔH3=+327 kJ/mol-151 kJ/mol+110 kJ/mol=+286 kJ/mol,即热化学方程式为:H2O(l)= H2(g)+
O2(g) ΔH=ΔH1+ΔH3+ΔH3=+327 kJ/mol-151 kJ/mol+110 kJ/mol=+286 kJ/mol,即热化学方程式为:H2O(l)= H2(g)+![]() O2(g) ΔH=+286 kJ/mol ;将系统II中3个反应相加得:H2S (g)= H2(g)+S(s) ΔH=ΔH2+ΔH3+ΔH4=-151 kJ/mol+110 kJ/mol+61 kJ/mol=+20 kJ/mol,即热化学方程式为:H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol,故答案为:H2O(l)= H2(g)+
O2(g) ΔH=+286 kJ/mol ;将系统II中3个反应相加得:H2S (g)= H2(g)+S(s) ΔH=ΔH2+ΔH3+ΔH4=-151 kJ/mol+110 kJ/mol+61 kJ/mol=+20 kJ/mol,即热化学方程式为:H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol,故答案为:H2O(l)= H2(g)+![]() O2(g) ΔH=+286 kJ/mol ;H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ;
O2(g) ΔH=+286 kJ/mol ;H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ;
(3)由图象可知E1表示反应物断键吸收的总能量,E2表示生成物形成放出的总能量,△H=反应物断键吸收的总能量生成物形成放出的总能量=E1E2,反应为放热反应,则△H=(E2E1)kJ/mol,加入催化剂能降低反应的活化能,所以E1和E2均减小,故答案为:-(E2E1)kJ/mol;减小;减小;
(4)根据平衡常数表达式分析知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g)是 由C(s) +H2O(g)
H2 (g) +CO2 (g)是 由C(s) +H2O(g)![]() CO(g) +H2(g)减去C(s)+CO2(g)
CO(g) +H2(g)减去C(s)+CO2(g)![]() 2CO(g) 所得,则K、K1、K2之间的关系是K=
2CO(g) 所得,则K、K1、K2之间的关系是K=![]() ,故答案为:K=
,故答案为:K=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是
A.CH2=CH2+HBr→CH3CH2Br
B.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3CH3 + Cl2 ![]() CH3CH2Cl + HCl
CH3CH2Cl + HCl
D.CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中加入![]() 、
、![]() 和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为
和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为![]() 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知只有
时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知只有![]() 阶段为使用催化剂;图一中
阶段为使用催化剂;图一中![]() 阶段
阶段![]() 未画出。
未画出。
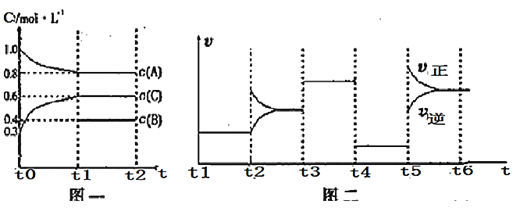
下列说法不正确的是
A.此温度下该反应的化学方程式![]()
![]()
B.![]() 阶段改变的条件为减小压强
阶段改变的条件为减小压强
C.B的起始物质的量为1mol
D.在相同条件下,若起始时容器中加入![]() 、
、![]() 和
和![]() ,要达到
,要达到![]() 时刻同样的平衡,a、b、c要满足的条件为
时刻同样的平衡,a、b、c要满足的条件为![]() 和
和 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生如下反应,并达到平衡:H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)。HI的体积分数HI%随时间变化如曲线(Ⅰ)所示,若改变反应条件,HI%的变化如曲线(Ⅱ)所示,则改变的条件可能是( )
2HI(g)+Q(Q>0)。HI的体积分数HI%随时间变化如曲线(Ⅰ)所示,若改变反应条件,HI%的变化如曲线(Ⅱ)所示,则改变的条件可能是( )
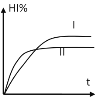
A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到炭、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废塑料的再利用。下列叙述中不正确的是( )

A.装置乙的试管中可收集到芳香烃B.装置丙中的试剂可吸收烯烃
C.最后收集的气体可作燃料D.该实验是聚丙烯发生加聚反应的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
Fe2O3(s)+![]() CO(g)=2/3Fe3O4(s)+
CO(g)=2/3Fe3O4(s)+![]() CO2(g) ΔH=-15.73kJ/mol
CO2(g) ΔH=-15.73kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ/mol
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
则56gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-327kJ/molB.+327kJ/mol
C.+436kJ/molD.-436kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
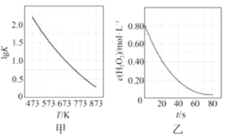
A.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目等于6×6.02×1023
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.图甲是CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
D.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2 : 2NO+2CO![]() N2+2CO2 ΔH<0下列对此反应的叙述中正确的是( )
N2+2CO2 ΔH<0下列对此反应的叙述中正确的是( )
A.降低温度能使v(正)增大,v(逆)减小,平衡正向移动,提高反应物的转化率
B.增大压强能使该反应的化学平衡常数K增大
C.使用光催化剂能增大NO的转化率
D.使用光催化剂能增大活化分子的百分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com