
����Ŀ������������Ӧ�÷dz��㷺���л��ܼ�����Ҫ����Ϳ�ϡ���ī��ճ�ϼ�����Ƭ��ҽҩ�����������ӡ���ױƷ��ʳƷ��ҵ�ȡ�ʵ���ҿ����������Ҵ���Ӧ�Ʊ�����������
(1)Ϊ�ж��������������һ�(-CH2CH3)��������ԭ�ӵ���Դ����û��һ�ֿɽ����б�ķ���__________��(�������ʵ��װ��ʵ�鲽�裬ֻ��������˼��)��
(2)Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴�������ˮ�������ã�ijͬѧ������ͼ��ʾװ�ý��������ĸ�ʵ�飬ʵ������������Թ�II�ٲ��л���ĺ�ȣ�ʵ���¼���£�
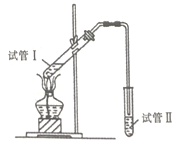
��� | �Թ�I�е��Լ� | �л�����/cm |
A | 3mL�Ҵ���2mL���ᡢ1mL18mol/LŨ���� | 3.0 |
B | 3mL�Ҵ���2mL���� | 0.1 |
C | 3mL�Ҵ���2mL���ᡢ6mL3mol/L���� | 1.2 |
D | 3mL�Ҵ���2mL���ᡢ���� | 1.2 |
���Թ�II���Լ�������Ϊ_______����������__________��
�ڷ����Ƚ�ʵ��_____(��ʵ����)�����ݣ����Ʋ��Ũ�������ˮ����������������IJ��ʡ�
�۷����Ƚ�ʵ��C��D��֤����������Ӧ���д����õ���H+��ʵ��D��Ӧ��������������Ũ�ȷֱ���_______mL��_____mol/L��
(3)�ִ���������̽����CH3CHOΪԭ�ϣ���(CH3CH2O)3Al���������ϳ�����������2CH3CHO![]() CH3COOCH2CH3
CH3COOCH2CH3
��ʵ�����н��и�ʵ��ʱ����ͬ�����µ�ʵ�������±���ʾ��
ʵ����� | ��������/g | ��Ӧ�¶�/�� | ��Ӧʱ��/h | ������/% | ѡ����/% | ת����/% |
1 | 0.368 | 6.5-2 | 52 | 0.35 | 99.9 | 99.6 |
2 | 0.278 | 10-0.5 | 52 | 0.12 | 99.81 | 95.39 |
3 | 0.368 | 6.5-2 | 12 | 0.1 | 99.8 | 99.7 |
4 | 0.368 | 10-0.5 | 52 | 0.8 | 99.5 | 97.3 |
��ע��ѡ���ԣ�ת����CH3CHO������CH3COOCH2CH3�İٷֱȡ�
����˵����ȷ����_______(����)��
A.����ȩ�ϳ������������ɼ��١���ҵ���ϡ����ŷ�
B.�¶�Խ�߷�Ӧ����Խ�죬��ȩ��ת����Խ��
C.����ȩ�ϳ����������ķ�Ӧʱ�������12hΪ��
D.������������Ӱ��ϳɷ�Ӧ��ѡ����ת����
E.(CH3CH2O)3Al����ȩ�����������ĸ�Ч����
���𰸡� �ú�18O���Ҵ������ᷴӦ������18O������ˮ�л��dz��������������� ����̼������Һ ���������ܽ�ȣ���ȥδ��Ӧ��������Ҵ� A 6 6 ACE
��������(1)�ж��������������һ�(-CH2CH3)��������ԭ�ӵ���Դ����Ʒ���Ϊ���ú�18O���Ҵ������ᷴӦ������18O������ˮ�л��dz��������������У�(2) ���Թ�II���Լ�������Ϊ����̼������Һ���������ǽ��������ܽ�ȣ���ȥδ��Ӧ��������Ҵ����ڢڶ���ʵ��A��B��֪���Թܢ����Լ�ʵ��A��ʵ��B��1mL18mol��L-1 Ũ���ᣬ�����Թܢ����Լ��в���л������������ĺ�ȣ�ʵ��AΪ3.0cm����ʵ��Bֻ��0.1cm���ʴ�Ϊ��A���۱������о�ʵ��D��ʵ��C����գ�֤��H+��������Ӧ���д����õ����������в�����һ��������ʵ��C3mol/L H2SO4��ʵ��D���ᣬ���Դﵽʵ��Ŀ�ģ�ʵ��D��ʵ��C��H+��Ũ��һ����ʵ��C3mL�Ҵ���2mL���ᡢ3mol/L H2SO4��ʵ��D3mL�Ҵ���2mL���ᡢ���ᣬҪ��֤��Һ���һ�£����ܱ�֤�Ҵ��������Ũ�Ȳ��䣬�������Ϊ6mL��ʵ��D��ʵ��C��H+��Ũ��һ�������������Ũ��Ϊ6mol/L��(3) A.����ȩ�ϳ������������ɼ�����ȩ���ŷţ�����١���ҵ���ϡ����ŷţ�ѡ��A��ȷ��B.�¶�Խ�߷�Ӧ����Խ�죬����ȩ�ӷ��¶�̫�߲�����ת���ʵ���ߣ�ѡ��B����C.�ɱ������ݿ�֪����ȩ�ϳ����������ķ�Ӧʱ�������12hΪ�ˣ���������ѡ���Ժ�ת���ʶ��ܸߣ�ѡ��C��ȷ��D.����������Ӱ��ϳɷ�Ӧ��ѡ����ת���ʣ�ѡ��D����E.�ɱ������ݿ�֪��(CH3CH2O)3Al����ȩ�����������ĸ�Ч������ѡ��E��ȷ����ѡACE��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(Na2S2O3)�dz��õĶ�Ӱ������ԭ�Է����Լ���Na2S2O3��5H2O����ɫ����,������ˮ,�������Ҵ�,�ڳ�ʪ�Ŀ������׳���,Na2S2O3�ͼ�ȩ���γ��ѱ�����Һ�����Ļ�����ס���������ȤС��������װ����ʵ�����Ʊ���������ơ�
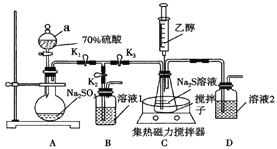
�ش��������⣺
(1)����a��������____________;��Һ1��____________��
(2)��С�鰴��ͼ���Ӻ�װ��,��K1��K3,�ر�K2,������a�Ļ���;Ƭ�̺�,����ʽ��������������;������ͨ����ƿ��,��Һ���ֻ�ɫ���Ǻ�����ʧ,��صĻ�ѧ��Ӧ����ʽΪ����_________________����Na2SO3+S![]() Na2S2O3��
Na2S2O3��
(3)����Ũ��������������Ĥ,ֹͣ����,��K2,�ر�K3,��ע����ע����ˮ�Ҵ����д������������������Ҵ���������__________________________________��
(4)��С�����Ʊ�Na2S2O3ʱ�����˸Ľ�����Cװ���е���Һ��ΪNa2CO3��Na2S���Һ,�䷴ӦΪ��Na2CO3+Na2S+4SO2=3Na2S2O3+CO2�����Ƹû����Һ�Ĺ�����,�Ƚ�Na2CO3��ȫ�ܽ�,�ٽ�Na2S�ܽ���Na2CO3����Һ��,��Ŀ����__________________��
(5)�ⶨ��С���Ʒ���ȡ�ȡ3.000gNa2S2O3��5H2O����,���100mL��Һ,ȡ20.00mL����ƿ��������Һ��pH��6,����������ȩ��Һ��Zn(CH3COO)2��Һ,����,ϴ�ӣ�����Һ�еμӼ��ε�����Һ,��0.1000mol/L������Һ�ζ�,���ı�����Һ10.00mL��
�ټ���������ȩ��Һ��Zn(CH3COO)2��Һ��Ŀ����_________________________________��
�ڸò�Ʒ��Na2S2O3��5H2O����������Ϊ_____________�� (��֪��2Na2S2O3+I2=Na2S4O6+2NaIKsp(ZnS)=1.6��10-24 M(Na2S2O3��5H2O)=248g/mol)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���̼���ƺ�̼�����ƵıȽϲ���ȷ���ǣ� ��
A.������ˮ�е��ܽ�Ȳ�ͬ����ͬ�¶��£�̼�����Ƶ��ܽ��С��̼����
B.�������ȶ��Բ�ͬ��̼���Ƶ����ȶ���ǿ��̼������
C.���߶��������ᷴӦ�ų�������̼���壬̼�������׳��մ��
D.������һ�������¿����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ���չǰ��������
��1�����ü״����Ƴ�����ȼ�ϵ�أ��������ォ��ѧ��ֱ��ת���ɵ��ܵ�װ�ã���ij����ȼ�ϵ��װ������ͼ��ʾ��A����________��������������������������缫��Ӧʽ��________��

��2���о�����CO2������Ժϳɼ״���CO2��H2�ɷ�������������Ӧ��
I��CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ��H1
CH3OH(g) + H2O(g) ��H1
II��CO2(g) + H2(g)![]() CO(g) + H2O(g) ��H2
CO(g) + H2O(g) ��H2
����ӦI�Ļ�ѧƽ�ⳣ������ʽK��________��
����������߷�ӦI�� CO2��ƽ��ת���ʵĴ�ʩ��________������ţ���
a��ʹ�ô��� b����ѹ c������CO2��H2�ij�ʼͶ�ϱ�
���о��¶ȶ��ڼ״����ʵ�Ӱ�졣��210 ��~290 �棬����ԭ������CO2��H2��Ͷ�ϱȲ��䣬��һ������ͨ�������ף���Ҫ������ӦI���õ��״���ʵ�ʲ��ʡ�ƽ��������¶ȵĹ�ϵ����ͼ��ʾ��

��H1________0�������������������������������________��
��ijʵ�����ѹǿһ����CO2��H2��ʼͶ�ϱ�һ������һ������ͨ�������ң�������ͬʱ��������ʵ�����ݣ���Ӧδ�ﵽƽ��״̬����
T��K�� | CO2ʵ��ת���ʣ�%�� | �״�ѡ������%����ע�� |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
��ע���״�ѡ���ԣ�ת����CO2�����ɼ״��İٷֱ�
����ʵ�����ݱ����������¶ȣ�CO2��ʵ��ת������߶��״���ѡ���Խ��ͣ���ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӿ������ijЩ�����ı���ԭ����(����)
A. ��ɾ���Ļ��������Ƿ��� B. ����ʱ������
C. �����������Է��Ӽ����������� D. �۵�һ���ԭ�Ӿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧȡ�����Ҽ�����ˮ���2~3 min����ȴ�����ˣ���ú�I����Һ�����������ʵ�鷽����������ȡI2��

��֪��3I2 + 6NaOH == 5NaI + NaIO3 + 3H2O
��1���Լ�a��������________��
��2���Լ�bӦѡ��________������ţ���
A��CCl4 B���� C���ƾ� D��ֲ����
��3������1��������________��
��4����Ӧ3�����ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������н������·�Ӧ��2SO2(��)+O2(��)![]() 2SO3(��)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2mol/L��0.1mol/L��0.2mol/L������Ӧ��ƽ��ʱ�����ܴ��ڵ�������
2SO3(��)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2mol/L��0.1mol/L��0.2mol/L������Ӧ��ƽ��ʱ�����ܴ��ڵ�������
A. SO2Ϊ0.4mol/L��O2Ϊ0.2mol/L B. SO3Ϊ0.4mol/L
C. SO2��SO3��Ϊ0.15mol/L D. SO2Ϊ0.25mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ��_________(����������������������������)����Һ��[Na+]______[CH3COO-](����>�� ��<������=��)��
��2�������£�pH=3�Ĵ����pH=11������������Һ�������Ϻ���Һ��__________(����������������������������)����Һ��[Na+]______[CH3COO-](����>�� ��<������=��)��
��3�����ʵ���Ũ����ȵĴ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����Ϻ���Һ��_______________(����������������������������)��������Һ�����______(����>�� ��<������=��)����������Һ�������
��4����mmol��L-1�Ĵ����nmol��L-1������������Һ�������Ϻ���Һ��pH=7���������Һ��c(H+)_______����������Һ��c(OH-)(����>�� ��<������=��)��m��n�Ĵ�С��ϵʽ_____________________��
���𰸡� ���� > ���� < ���� > < m>n
��������������Ҫ����������뼰������ˮ�⡣
��1����������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ��γɴ�������Һ��������ˮ��ʹ��Һ�ʼ��ԣ���Һ�е���غ㣺[H+]+[Na+]=[CH3COO-]+[OH-]���Ҽ�����Һ�У�[H+]<[OH-]������[Na+]>[CH3COO-]��
��2�������ѵ��룬�����£�pH=3�Ĵ����pH=11������������Һ�������Ϻ����ڴ���Ũ�Ƚϴ��ʣ�࣬�������ʹ��Һ�����ԣ���Һ�е���غ㣺[H+]+[Na+]=[CH3COO-]+[OH-]����������Һ����[H+]>[OH-]������[Na+]<[CH3COO-]��
��3�����ʵ���Ũ����ȵĴ��������������Һ��Ϻ���Һ�е���غ㣺[H+]+[Na+]=[CH3COO-]+[OH-]��������Һ�д�������Ӻ�������Ũ����ȣ�����[H+]=[OH-]�����Ϻ���Һ�����ԣ��루1���ȽϿ�֪������Һ�����>����������Һ�������
��4����mmol��L-1�Ĵ����nmol��L-1������������Һ�������Ϻ���Һ��pH=7�����ڴ����ѵ��룬�������Һ��c(H+)<����������Һ��c(OH-)���루1���ȽϿ�֪m��n�Ĵ�С��ϵʽΪm>n��
�����͡������
��������
23
����Ŀ��ij�¶�(T��)�µ���Һ�У�[H+]=10-xmol��L-1��[OH-]=10-y mol��L-1��x��y�Ĺ�ϵ��ͼ��ʾ����ش�����������
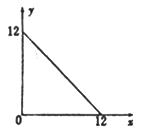
��1�����¶��£�ˮ�����ӻ�KW=______________������¶�T________25��(����>�� ��<������=��)��
��2���ڴ��¶��£���Ba(OH)2��Һ����μ���pH=a�����ᣬ��û����Һ�IJ���pH ���±���ʾ��
ʵ����� | Ba(OH)2��Һ�����/mL | ��������/mL | ��Һ��pH |
�� | 22.00 | 0.00 | 8 |
�� | 22.00 | 18.00 | 7 |
�� | 22.00 | 22.00 | 6 |
������Һ���ǰ�������仯���Բ��ƣ���a=________�� ʵ��������ˮ���������[OH-]=______mol��L-1��
��3���ڴ��¶��£���0.1mol��L-1��NaHSO4��Һ��0.1mol��L-1��Ba(OH)2��Һ���±��мס��ҡ���������ͬ��ʽ�����
�� | �� | �� | �� | |
0.1 mol��L-1Ba(OH)2��Һ���/mL | 10 | 10 | 10 | 10 |
0.1 mol L-l NaHSO4��Һ���/mL | 5 | 10 | 15 | 20 |
��������ʽ��Ϻ�������Һ��__________��(����������������������)��
��д�����ҷ�ʽ��Ϻ�Ӧ�����ӷ���ʽ��____________________ ��
������ʽ��Ϻ�������Һ��pH Ϊ_____________��
��4����25 ���£���a mol��L-1��NaCN��Һ��0.01mol��L-1������������ϣ���Ӧ������ҺpH=7����a________(����>�� ��<������=��)0.01���ú�a�Ĵ���ʽ��ʾHCN �ĵ��볣��Ka=___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��װ����ͼ��ʾ�ĵ绯ѧװ�ã�������˵����ȷ����

A. ͼ�м׳�Ϊԭ���װ�ã�Cu�缫������ԭ��Ӧ
B. ʵ������У��׳�����ձ���![]() ��Ũ�Ȳ���
��Ũ�Ȳ���
C. ����ͭ��U���������������������һ��ʱ���ȡ��U����������������С
D. ���׳���Ag�缫��������5.4gʱ���ҳ�ij�缫����1.6g�����������е�ij����Һ������AgNO3��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com