
【题目】甲醇是重要的化工原料,发展前景广阔。
(1)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如右图所示:A极是________极(填“正”或“负”),其电极反应式是________。

(2)研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
I.CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH1
CH3OH(g) + H2O(g) ΔH1
II.CO2(g) + H2(g)![]() CO(g) + H2O(g) ΔH2
CO(g) + H2O(g) ΔH2
①反应I的化学平衡常数表达式K=________。
②有利于提高反应I中 CO2的平衡转化率的措施有________(填序号)。
a.使用催化剂 b.加压 c.增大CO2和H2的初始投料比
③研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应I,得到甲醇的实际产率、平衡产率与温度的关系如右图所示。

ΔH1________0(填“>”、“=”或“<”),其依据是________。
④某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
T(K) | CO2实际转化率(%) | 甲醇选择性(%)【注】 |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
【注】甲醇选择性:转化的CO2中生成甲醇的百分比
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是________。
【答案】 负 CH3OH — 6e + H2O == CO2 + 6H+ ![]() b < 温度升高,甲醇的平衡产率降低 温度升高,I、II的反应速率均加快,但对II的反应速率的影响更大
b < 温度升高,甲醇的平衡产率降低 温度升高,I、II的反应速率均加快,但对II的反应速率的影响更大
【解析】(1)由电池装置图可知,该电池是甲醇燃料电池,由于使用了质子交换膜,所以电解质是酸性的,通入还原剂甲醇的电极A是负极,其电极反应式是CH3OH — 6e + H2O == CO2 + 6H+。
(2)①反应I的化学平衡常数表达式K=![]() 。
。
②反应I是一个气体分子数增大的反应,故加压有利于提高反应I中 CO2的平衡转化率,选b。增大CO2和H2的初始投料比,只能减小其转化率;催化剂不影响平衡转化率。
③由图可知,甲醇的平衡产率随温度升高而减小,所以该反应是放热反应,ΔH1< 0。
④表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是温度升高,I、II的反应速率均加快,但对II的反应速率的影响更大(即有更多的二氧化碳发生了副反应)。


科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. 钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+
B. HS﹣的水解方程式:HS﹣+H2O![]() S2﹣+H3O+
S2﹣+H3O+
C. CO32﹣的水解方程式:CO32﹣+H2O![]() HCO3﹣+OH﹣
HCO3﹣+OH﹣
D. AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中正确的是
A. 水电离出来的c(H+)=1×10-10mo1·L-1
B. 此时水的离子积KW=1×10-4
C. c(H+)=2[c(OH-)+c(SO42-)]
D. 该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。

下列关于实验现象的解释或结论正确的是
选项 | 实验现象 | 解释或结论 |
A | a中无明显现象 | Na2SO3和H2O2一定不发生反应 |
B | b中加稀H2SO4后才产生淡黄色沉淀 | SO32和S2两种离子一定不能大量共存 |
C | c中加BaCl2溶液后产生白色沉淀且红色褪去 | Ba2++ SO32 == BaSO3↓,使SO32水解平衡逆向移动,红色褪去 |
D | d中产生白色沉淀 | 原Na2SO3溶液中含有SO42 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出NaHCO3晶体,其反应的化学方程式是________。
②已知:ⅰ.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=127.4 kJ·mol 1
ⅱ.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=131.5 kJ·mol 1
反应2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g) ΔH= ________ kJ·mol 1。
(2)制备烧碱和硫酸。
用右图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜。则阳极区制备的溶液是________,阴极的电极反应式是________。
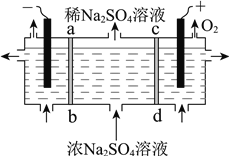
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列古诗词的描述中发生的是化学变化的是( )
A.千淘万漉虽辛苦,吹尽狂沙始到金
B.忽如一夜春风来,千树万树梨花开
C.春蚕到死丝方尽,蜡炬成灰泪始干
D.日照香炉生紫烟,遥看瀑布挂前川
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是应用非常广泛的有机溶剂,主要用于涂料、油墨、粘合剂、胶片、医药、化工、电子、化妆品及食品行业等。实验室可用乙酸与乙醇反应制备乙酸乙酯。
(1)为判断乙酸乙酯中与乙基(-CH2CH3)相连的氧原子的来源,请没计一种可进行判别的方案__________。(无需给出实验装置实验步骤,只需给出设计思想)。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行以下四个实验,实验结束后充分振荡试管II再测有机层的厚度,实验记录如下:
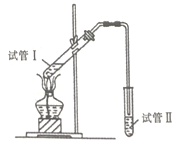
编号 | 试管I中的试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18mol/L浓硫酸 | 3.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①试管II中试剂的名称为_______,其作用是__________。
②分析比较实验_____(填实验编号)的数据,可推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
③分析比较实验C、D,证明对酯化反应具有催化作用的是H+。实验D中应加入盐酸的体积和浓度分别是_______mL和_____mol/L。
(3)现代化工生产探索以CH3CHO为原料,用(CH3CH2O)3Al作催化剂,合成乙酸乙酯:2CH3CHO![]() CH3COOCH2CH3
CH3COOCH2CH3
在实验室中进行该实验时,不同条件下的实验结果如下表所示:
实验序号 | 催化剂用量/g | 反应温度/℃ | 反应时间/h | 副产物/% | 选择性/% | 转化率/% |
1 | 0.368 | 6.5-2 | 52 | 0.35 | 99.9 | 99.6 |
2 | 0.278 | 10-0.5 | 52 | 0.12 | 99.81 | 95.39 |
3 | 0.368 | 6.5-2 | 12 | 0.1 | 99.8 | 99.7 |
4 | 0.368 | 10-0.5 | 52 | 0.8 | 99.5 | 97.3 |
(注)选择性:转化的CH3CHO中生成CH3COOCH2CH3的百分比。
下列说法正确的是_______(填编号)。
A.用乙醛合成乙酸乙酯,可减少“工业三废”的排放
B.温度越高反应速率越快,乙醛的转化率越高
C.用乙醛合成乙酸乙酯的反应时间控制在12h为宜
D.催化剂用量不会影响合成反应的选择性转化率
E.(CH3CH2O)3Al是乙醛制乙酸乙酯的高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4LCCl4含有NA个分子
B.0.1mol/L的HNO3中有0.1NA个H+
C.常温常压下,8gO2含有4NA个电子
D.1molNa被完全氧化生成Na+ , 失去2NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com