
【题目】我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出NaHCO3晶体,其反应的化学方程式是________。
②已知:ⅰ.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=127.4 kJ·mol 1
ⅱ.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=131.5 kJ·mol 1
反应2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g) ΔH= ________ kJ·mol 1。
(2)制备烧碱和硫酸。
用右图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜。则阳极区制备的溶液是________,阴极的电极反应式是________。
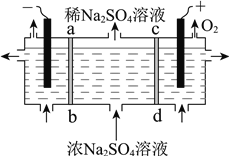
【答案】 Na2SO4 + 2NH4HCO3== 2NaHCO3↓+ (NH4)2SO4 +135.6 H2SO4溶液 2H+ + 2e– == H2↑或2H2O+ 2e– == H2↑+ 2OH
【解析】(1)①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出NaHCO3晶体,其反应的化学方程式是Na2SO4 + 2NH4HCO3== 2NaHCO3↓+ (NH4)2SO4。
②已知:ⅰ.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=127.4 kJ·mol 1
ⅱ.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=131.5 kJ·mol 1
由(ⅰ-ⅱ![]() )可得,2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g),所以该反应的ΔH=(127.4 kJ·mol 1)-(131.5 kJ·mol 1)
)可得,2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g),所以该反应的ΔH=(127.4 kJ·mol 1)-(131.5 kJ·mol 1)![]() +135.6 kJ·mol 1。
+135.6 kJ·mol 1。
(2)由图中信息可知,该装置左室为阴极室、右室为阳极室。因为电解后硫酸钠溶液浓度变小,所以电解过程中,硫酸根离子向阳极区移动、钠离子向阴极区移动。阳极氢氧根离子放电产生氧气,破坏了水的电离平衡,生成硫酸。阴极氢离子放电破坏了水的电离平衡生成氢氧化钠。综上所述,阳极区制备的溶液是H2SO4溶液,阴极的电极反应式是2H+ + 2e– == H2↑或2H2O+ 2e– == H2↑+ 2OH。


科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳酸钠和碳酸氢钠的比较不正确的是( )
A.二者在水中的溶解度不同,相同温度下,碳酸氢钠的溶解度小于碳酸钠
B.二者热稳定性不同,碳酸钠的热稳定性强于碳酸氢钠
C.二者都能与盐酸反应放出二氧化碳气体,碳酸氢钠俗称苏打或纯碱
D.二者在一定条件下可以相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中充入气体X和Y,发生反应X(g) + Y(g)![]() M(g) + N(g) ΔH,所得实验数据如下表:
M(g) + N(g) ΔH,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.40 | 0.10 | 0.080 |
③ | 800 | 0.20 | 0.05 | a |
下列说法正确的是
A. ①中,若5 min末测得n (M)=0.050 mol,则0至5 min内,用N表示的平均反应速率υ (N)=1.0×10 2 mol/(L·min)
B. 800 ℃,该反应的平衡常数K=2.0
C. ③中,达到平衡时,Y的转化率为80%
D. ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,发展前景广阔。
(1)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如右图所示:A极是________极(填“正”或“负”),其电极反应式是________。

(2)研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
I.CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH1
CH3OH(g) + H2O(g) ΔH1
II.CO2(g) + H2(g)![]() CO(g) + H2O(g) ΔH2
CO(g) + H2O(g) ΔH2
①反应I的化学平衡常数表达式K=________。
②有利于提高反应I中 CO2的平衡转化率的措施有________(填序号)。
a.使用催化剂 b.加压 c.增大CO2和H2的初始投料比
③研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应I,得到甲醇的实际产率、平衡产率与温度的关系如右图所示。

ΔH1________0(填“>”、“=”或“<”),其依据是________。
④某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
T(K) | CO2实际转化率(%) | 甲醇选择性(%)【注】 |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
【注】甲醇选择性:转化的CO2中生成甲醇的百分比
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子晶体具有某些特征的本质原因是( )
A. 组成晶体的基本粒子是分子 B. 熔融时不导电
C. 晶体内微粒间以分子间作用力相结合 D. 熔点一般比原子晶体低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应:2SO2(气)+O2(气)![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L、O2为0.2mol/L B. SO3为0.4mol/L
C. SO2、SO3均为0.15mol/L D. SO2为0.25mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com