
【题目】下列气体中不能用排空气法收集的是
A. SO2 B. NO C. NH3 D. Cl2
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在生产和生活中都发挥着重要的作用。
(1)SO2是形成酸雨的主要污染物,燃煤脱硫的原理为
2CaO(s)+2SO2(s)+O2(g)![]() 2CaSO4(s)
2CaSO4(s)
向10L恒温恒容密闭容器中加入3mol CaO,并通入2mol SO2和lmol O2发生上述反应,2min时达平衡,此时CaSO4为l.8mol。02min内,用SO2表示的该反应的速率v(SO2)=_________________;其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时SO2的转化率________(“填大”、“减小”或“不变”)。
(2)25℃时,H2SO3的电离常数Kal=1×10-2, Ka2=6×10-8,则该温度下NaHSO3的水解平衡常数Kb=_____________。判断NaHSO3溶液显________性(填“酸”、“碱”或“中”),用简要文字叙述原因是_______________________________。
(3)Na2SO3溶液作为吸收液可脱除烟气中的SO2。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
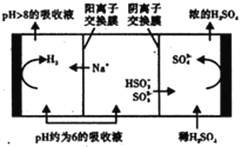
HSO3-在阳极放电时的电极反应式是________________________________。
(4)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g) △H>0
TaI4(g)+S2(g) △H>0
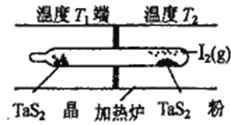
如上图所示,上述反应在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),—段时间后,在溫度为T1的一端得到了纯净的TaS2晶体,则温度T1 ______T2 (填“>”“<”或“=”)上述反应体系中循环使用的物质是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用品的有效成分及用途对应错误的是
选项 | A | B | C | D |
用品 | 食盐 | 小苏打 | 复方氢氧化铝片 | 漂白粉 |
有效成分 | NaCl | Na2CO3 | Al(OH)3 | Ca(ClO)2 |
用途 | 做调味品 | 做发酵粉 | 做抗酸药 | 做消毒剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的各级电离能数据如下:
I1 | I2 | I3 | I4 | I5 | I6 | |
I/(kJ·mol1) | 568 | 1517 | 9745 | 10978 | 13931 | 17978 |
则元素A常见价态是
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。

(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图a。
① B原子的杂化方式为________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:________。
(4)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图b所示。
① 与氮原子直接连接的硼原子构成的几何形状为________。硼原子和氮原子所连接的最小环为________元环。
② 晶胞有两个基本要素:
原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。
晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是( )
A.NH3B.Cl2C.H2D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末A,由CuSO4、CaCO3、BaCl2、Na2SO4、 NaOH中的两种或两种以上的物质混合而成,为探究其组成,进行如下实验(实验流程如图):

(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C,由此可判断,原白色粉末中一定不含有_____________。
(2)向白色沉淀B中加入一定量稀盐酸,沉淀全部溶解,并产生无色气体,由此可判断,原白色粉末中一定含有_________。
(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此判断,原白色粉末中一定还含有________。
(4)若流程图中无色滤液E中只含一种溶质,则无色滤液E中的溶质为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度时,100mL0.01molL﹣1的醋酸溶液与10mL 0.1molL﹣1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A.H+的物质的量B.醋酸的电离常数
C.中和时所需NaOH的量D.CH3COOH的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com