
【题目】有一包白色粉末A,由CuSO4、CaCO3、BaCl2、Na2SO4、 NaOH中的两种或两种以上的物质混合而成,为探究其组成,进行如下实验(实验流程如图):

(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C,由此可判断,原白色粉末中一定不含有_____________。
(2)向白色沉淀B中加入一定量稀盐酸,沉淀全部溶解,并产生无色气体,由此可判断,原白色粉末中一定含有_________。
(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此判断,原白色粉末中一定还含有________。
(4)若流程图中无色滤液E中只含一种溶质,则无色滤液E中的溶质为______。
【答案】 CuSO4 CaCO3 NaOH、BaCl2 NaCl
【解析】(1)、因所得滤液为无色滤液,而Cu2+让溶液呈蓝色,所以无CuSO4。
(2)、实验中生成的白色沉淀可能是CaCO3,也可能是硫酸钠和氯化钡生成的硫酸钡沉淀,因白色沉淀在稀盐酸中全部溶解并产生无色气体,而硫酸钡不溶于稀盐酸,则氯化钡和硫酸钠最多只能含有一种,沉淀不是硫酸钡,所以根据CaCO3+2HCl=CaCl2+H2O+CO2↑,则一定含有CaCO3。
(3)、向无色滤液C中通入二氧化碳能够得到白色沉淀D,说明滤液C中含有BaCl2和NaOH,如果含有BaCl2,则一定不含有硫酸钠;NaOH和CO2反应生成Na2CO3和H2O,Na2CO3和BaCl2反应生成白色沉淀BaCO3,所以原白色粉末中还一定含有BaCl2和NaOH。
(4)、因NaOH和CO2反应生成Na2CO3和H2O,Na2CO3和BaCl2反应生成BaCO3沉淀和NaCl,所以若无色滤液E中只含有一种溶质,则E应为NaCl。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.1%),还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
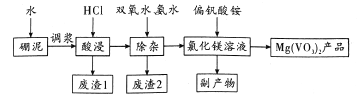
回答下列问题:
(l)Mg(VO3)2 中V的化合价为_____,副产物的电子式为_______。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为______。写出”酸浸”后溶液中存在的金属阳离子_______,废渣1可用于制作_______,该物质在信息传输中具有重要应用。
(3)“除杂”过程加人双氧水的目的是_______(用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于l×10-6mol·L-1,在室温下需调节pH范围为__________[已知Ksp[Fe(OH)3]= 1×10-39, Ksp[Al(OH)]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:__________。
(5)偏钒酸氨可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_________。
(6)现用a t硼泥生产Mg(VO3)2,若生产过程的产率为6%,则能生产出Mg(VO3)2产品的
质量为_________t (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,11.2L氧气所含的O原子数为NA
B. 1mol/L的CaCl2溶液中含有的Cl﹣为2NA
C. 2.4g镁转化为Mg2+时失去的电子数目为0.2NA
D. 标准状况下,2g氦气所含原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
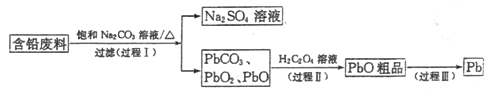
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见如图。
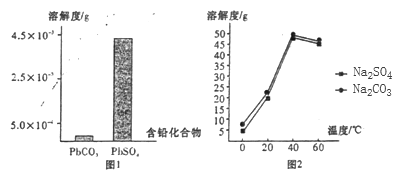
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据如图,解释可能原因:
i.温度降低,反应速率降低; ii.______________(请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是___________。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式__________。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图。
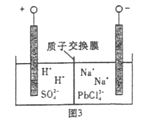
①阴极的电极反应式是____________。
②电解一段时间后,PbCl42-浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为________ mol·L-1。(假设电解前后硫酸溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8===Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是( )

A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-===Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所述物质一定不属于细胞膜组成成分的是
A. 含有C、H、O、N和P五种元素的脂质 B. 能与胰岛索特异性结合的物质
C. 转运氨基酸至一种无膜细胞器的物质 D. 能提高细胞与细胞之间黏着性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料。
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com