


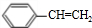 ,E为
,E为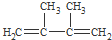 ,则乙苯与氯气在光照条件下发生侧链上的取代反应生成A为
,则乙苯与氯气在光照条件下发生侧链上的取代反应生成A为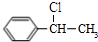 或
或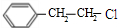 ,A在氢氧化钠醇溶液、加热条件下发生消去反应生成苯乙烯.C与溴发生加成反应生成D,D发生取代反应生成
,A在氢氧化钠醇溶液、加热条件下发生消去反应生成苯乙烯.C与溴发生加成反应生成D,D发生取代反应生成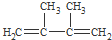 ,C分子结构中只含有一种氢,则C为
,C分子结构中只含有一种氢,则C为 ,D为
,D为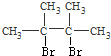 ,据此解答.
,据此解答.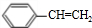 ,E为
,E为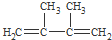 ,则乙苯与氯气在光照条件下发生侧链上的取代反应生成A为
,则乙苯与氯气在光照条件下发生侧链上的取代反应生成A为 或
或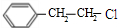 ,A在氢氧化钠醇溶液、加热条件下发生消去反应生成苯乙烯.C与溴发生加成反应生成D,D发生消去反应生成
,A在氢氧化钠醇溶液、加热条件下发生消去反应生成苯乙烯.C与溴发生加成反应生成D,D发生消去反应生成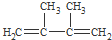 ,C分子结构中只含有一种氢,则C为
,C分子结构中只含有一种氢,则C为 ,D为
,D为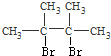 ,
,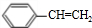 ,C的结构简式为:
,C的结构简式为: ,E的结构简式为:
,E的结构简式为: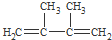 ,
,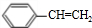 ;
; ;
;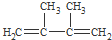 ;
;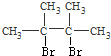 +2NaOH
+2NaOH| 水 |
| △ |
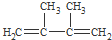 +2NaBr+2H2O,
+2NaBr+2H2O,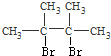 +2NaOH
+2NaOH| 水 |
| △ |
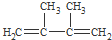 +2NaBr+2H2O.
+2NaBr+2H2O.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3 Na2O2+6 H2O=4Fe(OH)3↓+6 Na++2Fe3+ |
| B、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+O2↑+2 H2O |
| D、向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
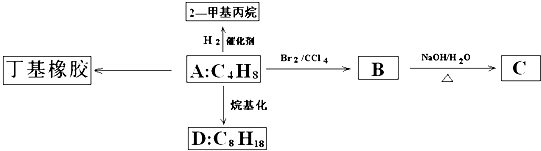
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 | 固体全部溶解则没有S生成 |
| 步骤2:取少许液体加HCl | |
| 步骤3 取少许液体加HCl和BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:| 15 |
| 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1mol/L氨水 |
| B、图②表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 |
| C、图③表示向CaCl2溶液中通入CO2 |
| D、图④表示向醋酸溶液中滴入氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com