
【题目】0.1mol·L-1NH4Al(SO4)2溶液的pH随温度变化的关系如曲线1所示,下列说法中正确的是
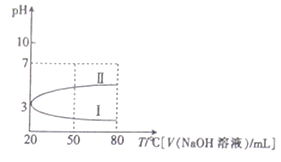
A. 0.1mol·L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+)
B. 向100mL0.1mol·L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol·L-1NaOH 溶液时,溶液pH的变化如曲线II
C. 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离
D. 20℃时,0.1mol·L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol·L-1
【答案】B
【解析】A.在NH4Al(SO4)2溶液中Al3+的水解抑制NH4+的水解,NH4HSO4溶液中H+也抑制NH4+的水解,且浓度相等时H+的抑制能力比Al3+强,则0.1mol·L-1NH4Al(SO4)2溶液c(NH4+)小于等浓度的NH4HSO4溶液中c(NH4+),故A错误;B.100mL0.1mol·L-1NH4Al(SO4)2溶液中NH4+和Al3+的物质的量为0.01mol,加入80mL0.05 mol·L-1NaOH 溶液的NaOH的物质的量为0.004mol,混合时发生Al3+部分生成Al(OH)3沉淀,混合液仍显酸性,故B正确;C.升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了Al3+和NH4+的水解,故C错误;D.20℃时,0.1molL-1 NH4Al(SO4)2中PH=3,根据电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,c(H+)+c(NH4+)+3c(Al3+)=c(OH-)+2c(SO42-),可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 molL-1,故D错误;答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
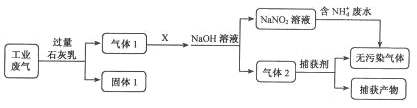
己知:NO+NO2+NaOH=NaNO2+H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
请回答下列问题:
(1)固体1中主要含有_________________________ (用化学式表示);
(2)X可以是________(填物质名称),且该物质需要________(填“少量”或“过量”);
(3)捕获剂所捕获的气体主要是________(用化学式表示);
(4)处理含NH4+废水时,发生反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是( )
A.X射线 B.天平 C.质谱 D.核磁共振
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烷烃的说法中,正确的是( )
A.通式为CnH2n
B.可以使酸性高锰酸钾溶液褪色
C.在光照下可与氯气发生加成反应
D.随分子中碳原子数的增加,烷烃的熔沸点升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
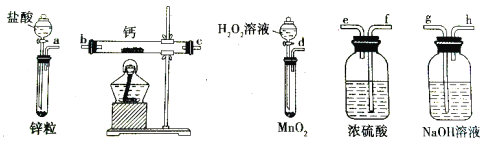
(1)请选择必要的装置,按气流方向连接顺序为____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后,________(填操作);④拆除装置,取出产物。
(3)若钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂, 设计实验检验钙的燃烧产物中是否含有过氧化钙________________。(简要说明实验步骤、现象和结论)
限选试剂:酸化的FeCl2溶液、NaOH溶液、KSCN溶液、稀硝酸
(4)利用反应Ca2++H2O2+2NH3+8H2O===CaO2·8H2O↓+2NH4+,在碱性环境下制取CaO2的装置如下:
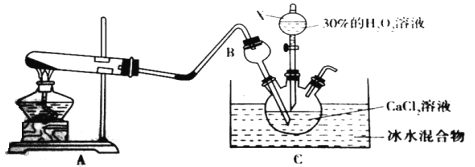
C中沉淀反应时常用冰水浴控制温度在0℃左右,其可能的原因分析:
该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
_______________ ______________。
(5)测定产品中CaO2含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的bg KI晶体,再滴入少量2mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3,溶液体积为V mL。
CaO2的质量分数为________(用字母表示)。[已知:I2+2S2O32-=2I-+S4O62-]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________;
(3)T1温度下该反应的化学平衡常数K1=___________;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=);
Ⅱ.根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
(1)此反应的△S 0(填“>”或“<”)。
已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H="-a" kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H ="-b" kJ·mol-1;CO的燃烧热△H ="-c" kJ·mol-1。
(2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
A.SO2(氧化物)
B.碘酒(单质)
C.HNO3(含氧酸)
D.氯水(混合物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com