
【题目】2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是( )
A.X射线 B.天平 C.质谱 D.核磁共振
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 第IA族的所有元素都是金属元素
B. 稀有气体元素原子的最外层电子数均为8
C. 同周期主族元素中,第ⅦA族元素原子半径最小
D. 第 IA族元素金属性强于第ⅡA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10ml 0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
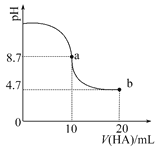
A. a点所示溶液中c(A-)+c(HA)=0.1mol·L-1
B. b点所示溶液中c(HA)>c(A-)
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. a、b两点所示溶液中水的电离程度a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种橡胶分解产物为碳氢化合物,对这种碳氢化合物作如下实验:
① 若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过石灰水,石灰水增重2.2 g。
② 经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍。
③ 该碳氢化合物0.1 mol能和32 g溴起加成反应.
④ 经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。下列说法正确的是( )
A.该碳氢化合物为2-甲基-1,3-戊二烯
B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物
C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物
D.该碳氢化合物与足量氢气加成时可以生成正戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z 在周期表中位置如右图。下列说法正确的是( )

A. 若 X 通过共用三对电子可形成 X2 分子,Z 在周期表中的位置是第三周期Ⅵ族
B. 若 X、Y、Z 都是金属,则它们的最高价氧化物的水化物都是强碱
C. 若它们原子最外层电子数之和为 13,则它们均为非金属元素
D. 若 X、Y、Z 都是非金属,则三者形成的简单氢化物中,Z 的氢化物沸点 最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol·L-1NH4Al(SO4)2溶液的pH随温度变化的关系如曲线1所示,下列说法中正确的是
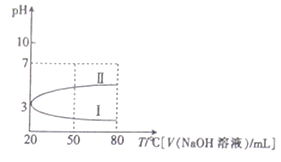
A. 0.1mol·L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+)
B. 向100mL0.1mol·L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol·L-1NaOH 溶液时,溶液pH的变化如曲线II
C. 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离
D. 20℃时,0.1mol·L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂。重复上述滴定操作2~3 次,记录数据如下。
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用待测盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数 ,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50 mL,所得溶液的pH为 。
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图像,当滴加NaOH溶液为10mL时,该混合液的pH= ,(含lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是 。

A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:

①滴定时,滴定终点时滴定现象是_____________。
②该草酸溶液的物质的量浓度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com