
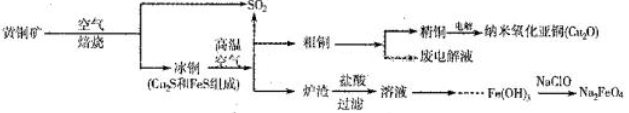
 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。 Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
 =12.5mol。
=12.5mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
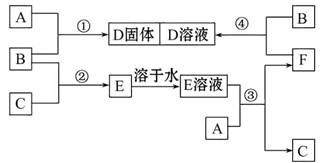
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.9 mol/L | B.0.85 mol/L | C.0.8 mol/L | D.0.75 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在潮湿的空气中放置不易生锈 |
| B.硬度比生铁小 |
| C.与3 mol/L盐酸的反应生成氢气 |
| D.与18.4 mol/L的硫酸反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶1 | B.2∶1 | C.1∶7 | D.2∶7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
| | FeO | Fe2O3 | CaO |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3+3H2O= Fe(OH)3↓+3HCl | B.Zn+2HCl=ZnCl2+H2↑ |
| C.3Zn+2FeCl3=3ZnCl2+2Fe | D.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com