

分析 电渗析法是近年发展起来的一种较好的海水淡化技术,但海水中含杂质,需过滤后通入到电解装置中,氢离子向阴极移动,则a为电源的负极,离子浓度大的为浓水,离子浓度小的为淡水,以此来解答.
解答 解:(1)海水中含有海水中含较多Mg2+和Ca2+等阳离子,电解时阴极附近生成氢氧根离子,导致氢氧根离子和钙镁离子反应生成Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜,从而抑制离子通过,导致电渗析法失败,则大海中的海水不能直接通入到装置中,理由是海水中往往有一些杂质,需要把海水经过净化、沉降、过滤后才能通入该装置中,
故答案为:不能;海水中往往有一些杂质,需要把海水经过净化、沉降、过滤后才能通入该装置中;
(2)由离子的定向移动可知,氢离子向阴极移动,则a为电源的负极,b为正极,故答案为:负; 正;
(3)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度变大,离子浓度大的为浓水,所以浓水在Ⅱ处排出,Ⅰ处排出的是淡水,故答案为:淡水;浓水.
点评 本题考查海水资源的应用,为高频考点,把握电渗析法淡化海水的原理为解答的关键,侧重分析与应用能力的考查,注意电解原理及应用,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
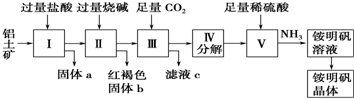
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
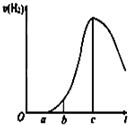 某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.
某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
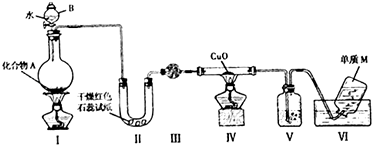
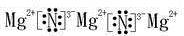 ,A与水反应的化学方程式Mg3N2 +6H2O=3Mg(OH)2↓+2NH3↑,比较A中阴阳离子的大小,阳离子半径小于阴离子半径(填大于,小于或等于)
,A与水反应的化学方程式Mg3N2 +6H2O=3Mg(OH)2↓+2NH3↑,比较A中阴阳离子的大小,阳离子半径小于阴离子半径(填大于,小于或等于)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的氨水与氯化铵溶液中,前者c(NH${\;}_{4}^{+}$)大 | |
| B. | CH3COONa溶液中滴加少量浓盐酸后,水电离程度增大 | |
| C. | 向Na2CO3溶液中加入NaOH溶液后,c(CO${\;}_{3}^{2-}$)增大 | |
| D. | 室温时AgCl分别加入水中与AgNO3溶液中,前者溶度积常数大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取氨气 制取氨气 | |
| B. |  可用于制备氢氧化亚铁并观察其颜色 可用于制备氢氧化亚铁并观察其颜色 | |
| C. |  X若为四氯化碳,可用于吸收氨气,并防止倒吸 X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. |  原电池,锌电极为负极,发生还原反应 原电池,锌电极为负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列关于该有机物的叙述不正确的是( )
.下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 在浓H2SO4催化下能与乙酸发生酯化反应 | |
| D. | 具有酸性,可以与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
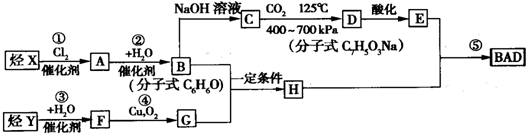

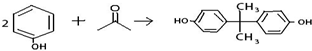
 .
. ;
;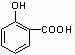 +
+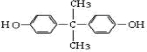 →
→ +2H2O.(不须写反应条件)
+2H2O.(不须写反应条件)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com