
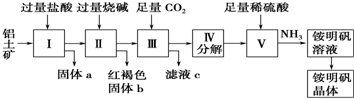
分析 铝土矿用盐酸溶解,Al2O3、Fe2O3与盐酸反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色固体b为氢氧化铁,溶液Ⅲ中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(1)Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,碳酸的酸性强于偏铝酸,故二氧化碳与偏铝酸钠生成氢氧化铝沉淀;
(2)Al2O3与稀硫酸、氨气反应生成铵明矾溶液;依据从可溶性溶液中获取固体的实验方法回答;
(3)依据化学反应方程式以及给出的数据计算即可;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,然后依据铝离子与硫酸根的关系回答即可.
解答 解:铝土矿用盐酸溶解,Al2O3、Fe2O3与盐酸反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色固体b为氢氧化铁,溶液Ⅲ中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2,Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3沉淀,
故答案为:SiO2; AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓;
(2)Al(OH)3分解生成Al2O3,Al2O3与稀硫酸、氨气反应生成铵明矾溶液,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤,
故答案为:Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O;蒸发浓缩;
(3)m(Al2O3)=1 000 kg×36%=360 kg,
依据:Al2O3+3H2SO4=Al2(SO4)3+3H2O
102 294
360kg m(H2SO4)
故m(H2SO4)=$\frac{294×360}{102}$=1037.6 kg,需消耗质量分数98%的硫酸(密度1.84 g•cm-3)为=$\frac{1037.6÷98%}{1.84}$=575.4 L,
故答案为:575.4;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,则Al3+共3 mol,SO42-共5 mol,根据Al3+和SO42-守恒原理可得,加入Al2O3和H2SO4的物质的量之比为:$\frac{3}{2}$:5=3:10,
故答案为:3:10.
点评 本题考查物质的分离和提纯的方法和基本操作综合应用,为高频考点,侧重于学生的分析能力的考查,题目注重氧化物与酸或碱的反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | 1组和2组探究②0.2mol/L温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ① | 5mL | 3滴 | |
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/LKOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (不考虑空间构型,如有配位键,请标出)
(不考虑空间构型,如有配位键,请标出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 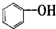 属于醇类化合物 属于醇类化合物 | B. | 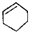 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 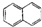 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 辛烯和3-甲基-1-丁烯 | B. | 甲苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲基环己烷和己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol O2作为氧化剂得到的电子数为2NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
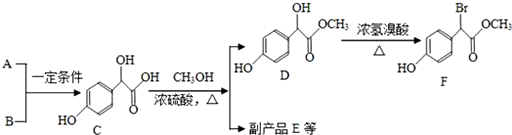
 .
.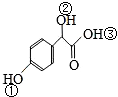 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
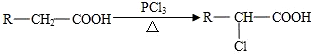
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com