
| A. |  制取氨气 制取氨气 | |
| B. |  可用于制备氢氧化亚铁并观察其颜色 可用于制备氢氧化亚铁并观察其颜色 | |
| C. |  X若为四氯化碳,可用于吸收氨气,并防止倒吸 X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. |  原电池,锌电极为负极,发生还原反应 原电池,锌电极为负极,发生还原反应 |
分析 A.氯化铵受热易分解生成氨气和氯化氢,在试管口冷却时氨气和氯化氢又反应生成氯化铵;
B.氢氧化亚铁易被空气中氧气氧化生成红褐色氢氧化铁沉淀,所以要隔绝空气制备氢氧化亚铁;
C.有缓冲作用的能防止倒吸;
D.原电池中易失电子的金属作负极,负极上失电子发生氧化反应.
解答 解:A.氯化铵受热易分解生成氨气和氯化氢,在试管口冷却时氨气和氯化氢又反应生成氯化铵,所以该装置得不到氨气,应该用氯化铵和氢氧化钙制取氨气,故A错误;
B.氢氧化亚铁易被空气中氧气氧化生成红褐色氢氧化铁沉淀,所以要隔绝空气制备氢氧化亚铁,应该将胶头滴管伸入液面下,故B错误;
C.有缓冲作用的能防止倒吸,水密度小于四氯化碳,氨气和四氯化碳不反应,所以该装置有缓冲作用,能防止倒吸,故C正确;
D.原电池中易失电子的金属作负极,负极上失电子发生氧化反应,该装置中Zn易失电子作负极,发生氧化反应,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及原电池原理、尾气处理、物质制备等知识点,明确实验原理、物质性质、实验基本操作方法是解本题关键,侧重考查学生分析判断及实验操作能力,易错选项是A.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
 .
.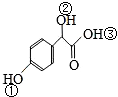 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类利用能源的三个阶段分别是:柴草时期、化石能源时期、多能源结构时期 | |
| B. | 人类使用沼气是对化学能的充分利用 | |
| C. | 发展低碳经济、循环经济,开发推广太阳能、水能、风能等能源,减少煤、石油等化石燃料的使用 | |
| D. | 生物质能主要指用树木、庄稼、草类等植物直接或间接提供的能量,它是不可再生的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
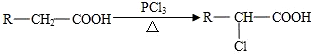
| A. | 沸点由高到低的排列顺序:HF>HI>HBr>HCl | |
| B. | PCl3和BF3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2O是极性分子,分子中O原子不处在2个H原子所连直线的中央 | |
| D. | 离子晶体可含有极性共价键,也可含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
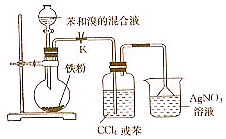 实验室用如图所示装置进行苯与溴反应的实验,请回答下列问题.
实验室用如图所示装置进行苯与溴反应的实验,请回答下列问题. +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe位于元素周期表的第四周期ⅧB族 | |
| B. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| C. | 工业上利用热还原法冶炼金属Fe | |
| D. | ${\;}_{41}^{92}Nb$3+原子核内有51个中子,核外有41个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
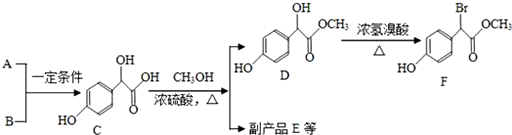
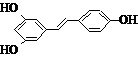 )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用.某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用.某课题组提出了如下合成路线: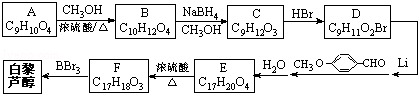

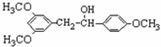 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$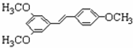 +H2O.
+H2O.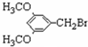 、E
、E .
.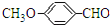 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com