
【题目】对于反应:2H2S+SO2=3S+2H2O,氧化剂与还原剂的物质的量之比为
A.1:1B.2:1C.3:1D.1:2
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示。
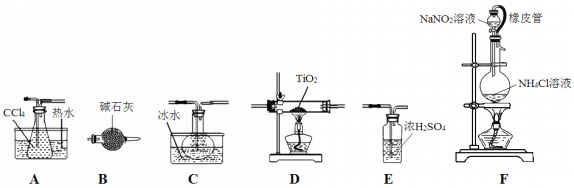
有关信息如下:
①反应原理:TiO2(s)+CCl4(g) △ T iCl4(g)+CO2(g)。
②反应条件:无水无氧且加热。
③有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它 |
CCl4 | 23 | 76 | 与TiCl4互溶 |
TiCl4 | 25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F橡皮管的作用是_________________________________________,装置F中有氮气生成,该反应的化学方程式为__________________________________________。
(2)实验装置依次连接的顺序为F→B→_____→_____→_____→_____。________________
(3)欲分离C中的液态混合物,所采用操作的名称是_____________。
(4)实验开始前首先点燃____处酒精灯(填“D或F”),目的是___________________。
(5)E装置______(填“能或不能”)换成B装置,理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物,汽车尾气用稀土/钯三效催化剂处理,不仅可以降低催化剂的成本,还可以提高催化效能。以氟碳铈矿(主要成分为CeCO3F)为原料制备CeO2的一种工艺流程如下:
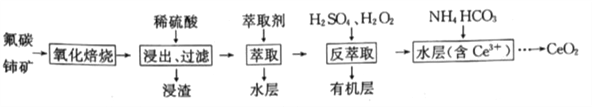
已知i.Ce4+能与F-结合成CeFx(4-x)+,也能与SO42-结合成(CeSO4)2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取:Ce4++n(HA)2![]() CeH2n-4A2n)+4H+,而Ce3+则不能。
CeH2n-4A2n)+4H+,而Ce3+则不能。
回答下列问题:
(1)CeCO3F中铈元素的化合价为_____,“氧化焙烧”过程中可以加快反应速率的方法是_____(答出两点即可)。
(2)“萃取”时,选用(HA)2作为萃取剂,(HA)2需满足的条件是________;“萃取”后的水层中含有的主要阴离子是________。
(3)“反萃取”时加入H2SO4的作用是__________;加入H2O2的作用是_______(结合离子方程式说明)
(4)浸渣经处理可得Ce(BF4)3,在KCl溶液中加入Ce(BF4)3,发生如下反应:Ce(BF4)3(s)+3K+(aq)![]() 3KBF4(s)+Ce3+(aq)
3KBF4(s)+Ce3+(aq)
一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,若上述反应体系中K+的物质的量浓度为cmol/L,则Ce3+的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12mL0.05mol/LRO32﹣溶液与10mL0.02mol/LX2O72﹣溶液混合恰好完全反应,已知RO32﹣反应后生成RO42﹣ , 则反应后X元素的化合价是( )
A.+6
B.0
C.+3
D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是

A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH)
D. 点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些物质的有关数据如下表,回答以下问题:
熔点(℃) | 沸点(℃) | 水溶性 | Ka1 | Ka2 | |||
乙醇 | -114.1 | 78.3 | 易溶 | 乙醇 | 2.6×10-16 | ||
乙醛 | -121 | 20.8 | 易溶 | H2SO3 | 1.23×10-2 | 5.6×10-8 | |
乙酸乙酯 | -83 | 77.0 | 难容 | H2CO3 | 4.2×10-7 | 5.6×10-11 |
实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是______________,解释该现象的化学反应方程式为____________;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:CH3CHO+NaHSO3![]()
![]() (a-羟基乙磺酸钠)
(a-羟基乙磺酸钠)
(2)写出Na2CO3溶液参与反应的化学方程式:________________;
(3)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。
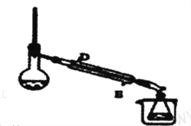
①冷凝管中的液体应从_____口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_____。(填字母)
a.烧杯中应装冰水 b.冷凝管应通温水 c.图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
实验试管 | pH | ||
第一次 | 第二次 | 第三次 | |
A | 12.42 | 12.40 | 12.38 |
b | 10.43 | 10.43 | 10.40 |
(4)试管a中乙醛溶液的物质的量浓度为___mol/L。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:
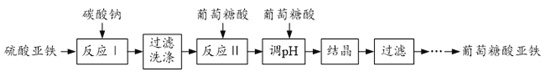
(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com