
| A. | 将NaOH放在天平左边托盘中的纸片上 | |
| B. | 将NaOH放入烧杯中(烧杯事先已称重),并放在天平左边托盘上 | |
| C. | 用镊子取出标定为10.1 g的砝码放在天平右边的托盘上 | |
| D. | 用镊子取出标定为10 g的砝码放在天平左边的托盘上,并将游码向右移到0.1 g位置上 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
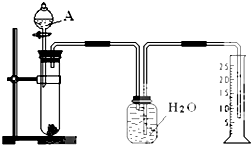 某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:
某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
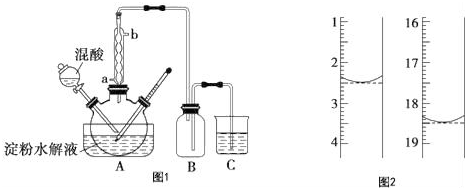
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,C的最高价氧化物水化物的电子式
,C的最高价氧化物水化物的电子式 ,淡黄色的固体E的电子式
,淡黄色的固体E的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可用于补钙药物的合成 | |
| B. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 生石灰可用作食品抗氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
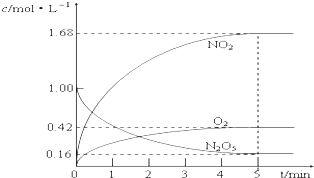 (1)该反应的化学方程式为2N2O5?4NO2+O2
(1)该反应的化学方程式为2N2O5?4NO2+O2查看答案和解析>>
科目:高中化学 来源: 题型:推断题
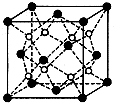 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com