
【题目】化学与生活、科学、技术、社会、环境密切相关,下列说法中错误的是
A. 常用明矾、硫酸铁等物质来处理污水中的悬浮物质
B. 硅单质可作为制造宇宙飞船太阳能电池帆板的主要材料
C. 硫酸铜溶液可用来浸泡蔬菜,以保持蔬菜的新鲜
D. 提倡使用共享单车,目的是为了降低碳排放
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. 用灼烧的方法可以区分蚕丝和人造纤维
B. 食用油反复加热会产生稠环芳香烃等有害物质
C. 福尔马林可用来浸制标本,因其可使蛋白质变性
D. 医用消毒酒精中乙醇的浓度为95%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。
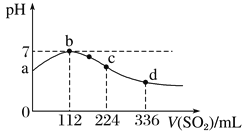
下列分析正确的是
A. 原H2S溶液的物质的量浓度为0.05 mol/L
B. 氢硫酸的酸性比亚硫酸的酸性强
C. b点水的电离程度比c点水的电离程度大
D. a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子显电中性的原因是( )
A. 构成原子的各种微粒均不带电
B. 原子核外电子数大于核内质子数
C. 原子核所带电量和核外电子的电量相等,但电性相反
D. 核内质子数等于核电荷数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在共价化合物中,元素化合价有正负的主要原因是 ( )
A. 电子有得失 B. 电子既有得失又有电子对偏移
C. 共用电子对有偏移 D. 有金属元素的存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如下工艺流程法制得。
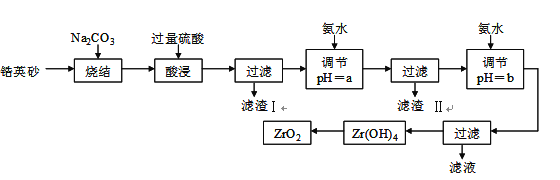
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。②部分金属离子开始沉淀和完全沉淀的pH如下表:
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀的pH | 1.9 | 3.3 | 6.2 |
沉淀完全的pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
⑴烧结时ZrSiO4发生反应的化学方程式为_______________________;
滤渣I的化学式为______________________________。
⑵调节pH=a 的目的是________________________________________;用氨水调节pH=b后发生反应的离子方程式为______________________________________________。
⑶以滤渣II为主要原料制取铁红,请简述实验方法________________________。
⑷工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:
________________________________________________________。
⑸一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入甲烷,写出负极的电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. NH3极易溶于水,可用于工业制冷剂
B. HNO3具有酸性,可用于制备硝酸盐原料
C. NH4 NO3易溶于水,可用于制造高温材料
D. N2难溶于水,可用于合成氨原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数98%密度为1.84 g·cm-3浓H2SO4来配制450 mL、0.2 mol·L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有________(填代号)。
(2)经计算,需浓H2SO4的体积为________。现有① 5 mL ②10 mL ③20 mL ④50 mL三种规格量筒,你选用的量筒是_____。
(3)补充整个配制过程的步骤:计算—称量—溶解—_______—______—摇匀。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是_____,能引起浓度偏高的有___(填代号)。
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/ ![]() )和质量分数为36.5%的浓盐酸(密度1.19g/
)和质量分数为36.5%的浓盐酸(密度1.19g/ ![]() )来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A. 该王水中硝酸的物质的量浓度是3.5mol/L
B. 该王水中氧元素的质量是100.8g
C. 该王水的密度约为1.24g/ ![]()
D. 该王水中HCl的质量分数约为26.2%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com