
����Ŀ��������������98%�ܶ�Ϊ1.84 g��cm��3ŨH2SO4������450 mL��0.2 mol��L��1��ϡH2SO4.�ɹ�ѡ��������У��ٲ����� ����ƿ ���ձ� �ܽ�ͷ�ι� ����Ͳ ������ƿ ��������ƽ ��ҩ�ס���ش��������⣺
��1�����������У�������ϡH2SO4ʱ�ò�������________(�����)��
��2�������㣬��ŨH2SO4�����Ϊ________�����Т� 5 mL ��10 mL ��20 mL ��50 mL���ֹ����Ͳ����ѡ�õ���Ͳ��_____��
��3�������������ƹ��̵IJ��裺�������������ܽ���_______��______��ҡ�ȡ�
��4�������ƹ����У�����������ȷ�����в����У��������_____��������Ũ��ƫ�ߵ���___(�����)��
�ٽ�ŨH2SO4ֱ�ӵ����ձ��������ձ���ע������ˮ��ϡ��ŨH2SO4
��δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ��
��ϴ���ܽ��õ��ձ��벣����������ϴ��Һת�Ƶ�����ƿ��
��ת��ǰ������ƿ�к�����������ˮ
�ݶ���ʱ�����ӱ���
����ҡ�Ⱥ���Һ����ڱ��ߣ����ý�ͷ�ιܼ�����ˮ������
���𰸡� �ڢߢ� 5.4mL �� ת�� ���� �٢ڢݢ� �ڢ�
��������������Ҫ����һ�����ʵ���Ũ����Һ�����Ʒ�������������
��1�����������У�������ϡH2SO4ʱ�ò������Тڢߢ���
��2��cŨ=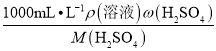 =
=![]() =19.8mol/L������500mL����ƿ����0.2 mol��L��1��ϡH2SO4��cŨVŨ=cϡVϡ��VŨ=cϡVϡ/cŨ=0.2mol��L��1L��500mL/(19.8 mol��L��1)=5.4mL��������ŨH2SO4�����Ϊ5.4mL��ѡ����Ͳ�Ĺ��Ӧ�ӽ�5.4mL�Ҳ�С��5.4mL��ѡ�õ���Ͳ�Ǣ���
=19.8mol/L������500mL����ƿ����0.2 mol��L��1��ϡH2SO4��cŨVŨ=cϡVϡ��VŨ=cϡVϡ/cŨ=0.2mol��L��1L��500mL/(19.8 mol��L��1)=5.4mL��������ŨH2SO4�����Ϊ5.4mL��ѡ����Ͳ�Ĺ��Ӧ�ӽ�5.4mL�Ҳ�С��5.4mL��ѡ�õ���Ͳ�Ǣ���
��3�������������ƹ��̵IJ��裺�������������ܽ���ת����Һ��������ҡ�ȡ�
��4����Ӧ��Ũ�������ձ��ڱڻ���ע���ձ��е�����ˮ�У������Ͻ���ɢ�ȣ��ʢٴ�����Һ��ȴ�������С���ʢڴ�������Ũ��ƫ�ߣ�����ȷ���ܲ�Ӱ����������Һ������٣��ʢݴ�������Ũ��ƫ�ߣ�����Һ������ʢ�������Ũ��ƫ�͡��ʴ�����Ǣ٢ڢݢޣ�������Ũ��ƫ�ߵ��Тڢݡ�


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ��Ƴ����ڵ�·�ڱ��������������������ˮ�������������ʡ�ʵ�����ù�ҵ����ʯ����������Al2O3��Fe2O3�����ʣ��Ʊ��Ȼ��Ƶ���Ҫ�������£�
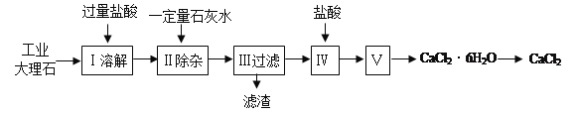 ���������գ�
���������գ�
��1������ʹ�õ���������ʵ���Ũ��ԼΪ6.0mol/L������36.5%�����ᣨ�ܶ�Ϊ1.2g/mL������6.0mol/L������100mL������IJ��������в���������Ͳ����ͷ�ιܡ� ����Ҫ��ȡ36.5%������ mL�����ƹ����У���������������ȷ�����в���������Ũ��ƫС���� ��
A������ҡ�Ⱥ���Һ����ڿ̶��� |
B������ʱ��������ƿ�Ŀ̶��� |
C������Һת������ƿ��û��ϴ���ձ��Ͳ���������ת�붨�ݲ��� |
D�������ˮ�����˿̶��ߣ�ȡ������ˮʹҺ��ǡ�õ��̶��� |
��2�����������йط�Ӧ�����ӷ���ʽ�У� �� �� ��
��3������������ʯ��ˮ������Ŀ���Ƿ�ֹ�������ӷ���ʽ��ʾ���� ��
��4����������Ҫ�ɷ��У�д��ѧʽ�� ��
��5�������������IJ��������� �� ��
��6���Ƶõ��Ȼ��ƿ���ͨ�����²���ⶨ�䴿�ȣ�
����ȡ5.5g��ˮ�Ȼ�����Ʒ�����ܽ⣻����������Na2CO3��Һ����ַ�Ӧ����ˣ��� �� �������������õ�4.3g̼��ƣ����Ȼ��Ƶ���������Ϊ ����ʵ������淶���ⶨ���ƫ�ͣ���ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������ѧ����������ᡢ����������أ�����˵���д������
A. ������������������������������ˮ�е���������
B. �赥�ʿ���Ϊ��������ɴ�̫���ܵ�ط������Ҫ����
C. ����ͭ��Һ�����������߲ˣ��Ա����߲˵�����
D. �ᳫʹ�ù���������Ŀ����Ϊ�˽���̼�ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ï��[(C5H5)2Fe]�ķ������л������������о��о�����̱�������¼������������л������������о�����������֪��ï���۵���173 ��(��100 ��ʱ��ʼ����)���е���249 ����������ˮ�������ڱ������ѵȷǼ����ܼ�������˵������ȷ����( )
A. ��ï�����ڷ��Ӿ���
B. �ڶ�ï���ṹ�У�C5H![]() ��Fe2��֮���γɵĻ�ѧ�����������Ӽ�
��Fe2��֮���γɵĻ�ѧ�����������Ӽ�
C. ��֪�������ϩ�ĽṹʽΪ�� �������н���1��̼ԭ�Ӳ�ȡsp3�ӻ�
�������н���1��̼ԭ�Ӳ�ȡsp3�ӻ�
D. C5H![]() ��һ��������
��һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10mL 0.40mol/L H2O2��Һ�������ֽ⣬��ͬʱ�̲������O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2)�� 3.3��10��2 mol/(Lmin)
B. 6��10 min��ƽ����Ӧ���ʣ�v(H2O2)�� 3.3��10��2 mol/(Lmin)
C. ��Ӧ��6 minʱ��H2O2�ֽ���50%
D. ��Ӧ��6 minʱ��c(H2O2)=0.30 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����(����)

A. ˮ��ͭ���ӵ�ģ����ͼ����ʾ��1��ˮ��ͭ��������4����λ��
B. CaF2����ľ�����ͼ����ʾ��ÿ��CaF2����ƽ��ռ��4��Ca2��
C. Hԭ�ӵĵ�����ͼ��ͼ����ʾ��Hԭ�Ӻ�������������ԭ�Ӻ˸����˶�
D. ����Cu��Cuԭ�Ӷѻ�ģ����ͼ����ʾ��Ϊ���ܶѻ���ÿ��Cuԭ�ӵ���λ����Ϊ12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������һ�����ʡ� ������������
A���� B������������ C���� D�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���5.6g����4.6g�Ʒֱ���100m L 1mol/L�����ᷴӦ ����ų�H2������� ��
A. ���Ķ� B. �ƵĶ� C. �����Ʒų�һ���� D. ���Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵȼ��ú��ʯ�͵Ȼ�ʯȼ���ͷų�������������(NOx)��CO2��SO2�����壬������Ⱦ�������Է���������������̼����������ʵ����ɫ�������������á�
��.������
��֪��H2��ȼ����Ϊ285.8 kJ��mol-1
N2(g)+2O2(g) =2NO2(g) ��H = +133 kJ��mol-1
H2O(g) = H2O(l) ��H =��44 kJ��mol-1
���������£�H2��ԭNO2����ˮ���������������ʵ��Ȼ�ѧ����ʽΪ��__________________________��
��.��̼��
��1����2L�ܱ������м���2molCO2��6molH2�����ʵ��Ĵ��������£�������Ӧ��CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
�ٸ÷�Ӧ�Է����е�������_____________(����¡��������¡��������¶ȡ�)��
������������˵���˷�Ӧ�ﵽƽ��״̬����____________��(����ĸ)
a.��������ƽ��Ħ���������ֲ��� b.CO2��H2������������ֲ���
c.CO2��H2��ת������� d.���������ܶȱ��ֲ���
e.1molCO2���ɵ�ͬʱ��3mol H��H������
��CO2��Ũ����ʱ�䣨0��t2���仯����ͼ��ʾ����t2ʱ�������ݻ���Сһ����t3ʱ�ﵽƽ�⣬t4ʱ�����¶ȣ�t5ʱ�ﵽƽ�⣬�뻭��t2��t6 CO2Ũ����ʱ��ı仯��________________________

��2���ı��¶ȣ�ʹ��ӦCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H��0�е��������ʶ�Ϊ��̬����ʼ�¶ȡ������ͬ��T1�桢2L�ܱ�����������Ӧ�����в������ݼ��±���
CH3OH(g)+H2O(g) ��H��0�е��������ʶ�Ϊ��̬����ʼ�¶ȡ������ͬ��T1�桢2L�ܱ�����������Ӧ�����в������ݼ��±���
��Ӧʱ�� | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
��Ӧ���º��� | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
��Ӧ���Ⱥ��� | 0min | 0 | 0 | 2 | 2 |
�ٴﵽƽ��ʱ����Ӧ��Աȣ�ƽ�ⳣ��K(I)______ K(II)���������������������ͬ����ƽ��ʱCH3OH��Ũ��c(I)____ c(II)��
�ڶԷ�Ӧ��ǰ10min�ڵ�ƽ����Ӧ����v(CH3OH) =______________ ���������������������£���30minʱֻ�ı��¶�T2�棬��ʱH2�����ʵ���Ϊ3.2mol����T1___T2(�>������<����=��)����30minʱֻ���������ٳ���1molCO2(g)��1molH2O(g)����ƽ��_____�ƶ�(�������������)��
��3�������˹�������ÿɽ�CO2ת��Ϊ���ᣬ��Ӧԭ��Ϊ2CO2+2H2O=2HCOOH+O2��װ����ͼ��ʾ��

�ٵ缫2�ĵ缫��Ӧʽ��____________��
���ڱ�״���£����缫2����11.2L CO2��Ӧ�� �����ϵ缫1��Һ������_____(����ӡ����١�)______g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com