
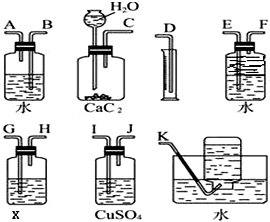
 实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)
实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)| 150g×3.2% |
| 160g/mol |
| V×10-3L |
| 22.4L/mol |
| V |
| 22400 |
| V |
| 22400 |
| V |
| 22400 |
(0.015+
| ||
| W |
(0.015+
| ||
| W |


科目:高中化学 来源: 题型:
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
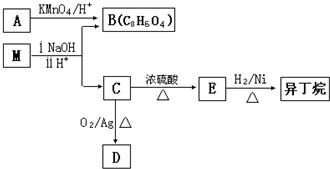
查看答案和解析>>
科目:高中化学 来源: 题型:
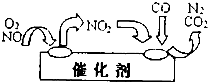 直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.
直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤 |
| B、不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液 |
| C、制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 |
| D、某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定含有大量CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.32g |
| B、4.16g |
| C、4.58g |
| D、4.41g |
查看答案和解析>>
科目:高中化学 来源: 题型:
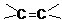 的方法是
的方法是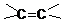 应先检验哪一个官能团?
应先检验哪一个官能团?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com