
 直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.
直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.
| ||
| ||
| ||
| ||
| 56L |
| 22.4L/mol |
| 42.5g |
| 17g/mol |
| 2.5mol |
| 2.5mol |
| 6 |
| 4x |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
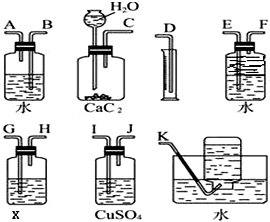 实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)
实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)查看答案和解析>>
科目:高中化学 来源: 题型:
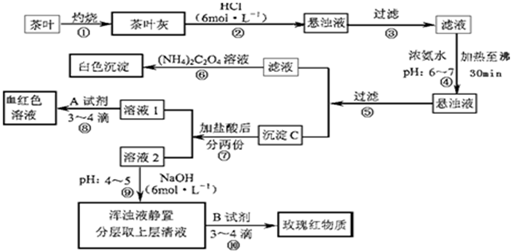
查看答案和解析>>
科目:高中化学 来源: 题型:
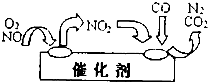
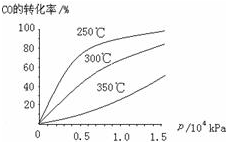 研究NO2、SO2、CO等大气污染气体的处理有重要意义.
研究NO2、SO2、CO等大气污染气体的处理有重要意义.| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食物溶于水后的溶液中pH<7,则为酸性食物 |
| B、由C、N、S、P等元素组成的蛋白质是酸性食物 |
| C、蔬菜、水果多含钾、钠、钙、镁等盐类及果酸,习惯称为酸性食物 |
| D、柠檬酸是酸性食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com