


科目:高中化学 来源: 题型:
| A、向裂化汽油中滴加少量酸性高锰酸钾溶液,振荡.若紫红色褪去,即可证明其中含甲苯等苯的同系物 |
| B、选用新制Cu(OH)2悬浊液可以鉴别水、苯、溴苯、乙醛和乙酸 |
| C、采用普通蒸馏装置,将溴的四氯化碳溶液中的溶质与溶剂分离 |
| D、检验某铁粉样品中是否有少量氧化铁杂质,实验步骤为:取少许样品,用盐酸溶解,然后滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
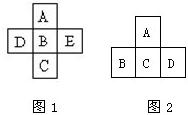 (Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示:
(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用青霉素前一定要进行皮肤敏感试验 |
| B、为使药物易于吸收,最好用茶水送服 |
| C、少量鸦片可作镇痛药,过量则会中毒 |
| D、青霉素是一种高效的抗菌消炎药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com