
| 1000ρw |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| 0.2mol/L×0.5L |
| 18.4mol/L |


科目:高中化学 来源: 题型:
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
| CuO2/H2SO4 |
 )是一种医药中间体,用茴香醛(
)是一种医药中间体,用茴香醛(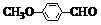 )经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
)经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
 转化为
转化为 ,其合成线路如下:
,其合成线路如下: 写(Ⅱ)(Ⅲ)两步反应的化学方程式:
写(Ⅱ)(Ⅲ)两步反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
12 6 |
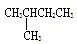 和
和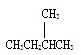
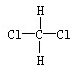 和
和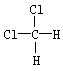 F、CH3CH2CH2CH3和
F、CH3CH2CH2CH3和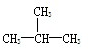
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 碱 | 盐 | 酸性氧化物 | |
| A | 硝酸 | 纯碱 | 烧碱 | 二氧化硫 |
| B | 硫酸 | 烧碱 | 食盐 | 一氧化碳 |
| C | 醋酸 | 苛性钠 | 石灰石 | 水 |
| D | 碳酸 | 苛性钾 | 硫酸钡 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com