
| A、向裂化汽油中滴加少量酸性高锰酸钾溶液,振荡.若紫红色褪去,即可证明其中含甲苯等苯的同系物 |
| B、选用新制Cu(OH)2悬浊液可以鉴别水、苯、溴苯、乙醛和乙酸 |
| C、采用普通蒸馏装置,将溴的四氯化碳溶液中的溶质与溶剂分离 |
| D、检验某铁粉样品中是否有少量氧化铁杂质,实验步骤为:取少许样品,用盐酸溶解,然后滴加KSCN溶液 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH- →BaSO4↓+2NH3?H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+4OH- →Mg(OH)2↓+2CO32-+2H2O |
| C | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+→SO2↑+H2O |
| D | K+、NH3?H2O、CO32- | 通入少量CO2 | 2NH3?H2O+CO2 →2NH4++CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
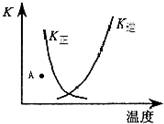
| A、正反应为吸热反应 | ||
| B、升高温度,有利于反应向正方向进行 | ||
| C、A点时,反应向逆反应方向移动 | ||
D、K正与K逆的关系是:K正=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种溶液的pH的大小顺序:①>④>③>② |
| B、将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>② |
| D、将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
| CuO2/H2SO4 |
 )是一种医药中间体,用茴香醛(
)是一种医药中间体,用茴香醛(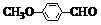 )经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
)经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
 转化为
转化为 ,其合成线路如下:
,其合成线路如下: 写(Ⅱ)(Ⅲ)两步反应的化学方程式:
写(Ⅱ)(Ⅲ)两步反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com