
【题目】等质量的下列有机物完全燃烧消耗氧气(相同状况下)最多的是
A. CH4 B. C2H4 C. C2H2 D. C6H6
【答案】A
【解析】
由烃燃烧中C~O2~CO2,4H~O2~2H2O可知,消耗1 mol O2需要12 g C,而消耗1 mol O2需要4 g H,可知烃中含氢量越大,所以相同质量烃CxHy燃烧耗氧量规律:氢的质量分数越大,完全燃烧耗氧越多,即![]() 值越大,耗氧量越大。
值越大,耗氧量越大。
相同质量烃CxHy燃烧,氢的质量分数越大,完全燃烧耗氧量越多。
A. CH4中H原子与C原子个数比为4:1;
B. C2H4中H原子与C原子个数比为4:2=2:1;
C.C2H2中H原子与C原子个数比为2:2=1:1;
D. C6H6中H原子与C原子个数比为6:6=1:1;
所以相同质量的各烃甲烷的燃烧耗氧量最大,故A项正确;
答案选A。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径与原子序数的关系如图所示.则下列说法正确的是( )

A.简单离子半径: Z>N
B.简单氢化物的稳定性: P > X
C.由 X 与 M 两种元素组成的化合物不能与任何酸 反应,但能与强碱反应
D.Z 的氧化物能溶解于 Y 的最高价氧化物对应水化 物的水溶液中,也能溶解于 P 的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:
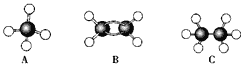
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的 _____________。
_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按如图所示装置进行实验,并回答下列问题:

(1)甲池,通入CH3OH(甲醇)的电极反应式为______________________。
(2)乙池中的总反应化学方程式为______________________。
(3)当甲池中消耗O20.56L(标准状况下)时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“c”或“d”)电极折出1.20g金属,则按丙装置中的的某盐溶液可能是__________________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
Ⅱ.SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控利和治理是优化我们生存环境的有效途径。

(4)利用化学原理将C0、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO一极为____________________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为____________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:

(1)H的分子式为 。
(2)B所含官能团的名称为 。
(3)含两个—COOCH3基团的C的同分异构体共有 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 。
(4)B→D,D→E的反应类型分别为 、 。
(5)G为含六元环的化合物,写出其结构简式: 。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为 。
(7)写出E→F的化学方程式: 。
(8)A的结构简式为 ,A与等物质的量的Br2进行加成反应的产物共有 种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:a.NaOH+HCl=NaCl+H2O b.Cu+2Ag+ =Cu2+ +2Ag
(1)反应____(填字母)不能设计成原电池。原因是__________________________。
(2)a反应为______反应(填“放热”或“吸热”),NaOH和HCl的总能量________(填“大于”“小于”或“等于”)NaCl和H2O的总能量。
(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键_____431 kJ的能量,形成1molH-Cl键_____431 kJ的能量。(填“吸收”或“放出”)
(4)反应____(填字母)能设计成原电池,请画出实验装置图,注明电极材料和电解质溶液。__________

写出电极反应式及反应类型
正极反应式:_____________________,
反应类型:_______________________,
负极反应式:_____________________。
(5)上题所设计原电池中,向正极移动的离子为_______,电池工作一段时间后,电解质溶液质量减轻7.6g,正极增重的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A. 以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C. 其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92 kJ/mol
2NH3 △H=-92 kJ/mol
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热不改变
D. 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com