
【题目】H2和I2在一定条件下能发生反应:已知(a、b、c 均大于零):H2(g)+I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1。
2HI(g) ΔH=-a kJ·mol-1。
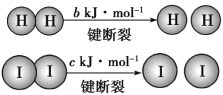
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1mol HH键和1 mol II键所需能量大于断开2 mol HI键所需能量
C.断开2mol HI键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量小于2akJ
【答案】B
【解析】
根据ΔH=反应物的总键能-生成物的总键能,结合题给信息,可知反应H2(g)+I2(g)![]() 2HI(g) ΔH=HH键键能+II键键能-2×HI键键能。据此进行分析。
2HI(g) ΔH=HH键键能+II键键能-2×HI键键能。据此进行分析。
A.由题给信息a>0,可知该反应的ΔH<0,根据ΔH=生成物的总能量-反应物的总能量,可知该反应反应物的总能量高于生成物的总能量,A项正确;
B.由题给信息,可知:HH键键能+II键键能-2×HI键键能<0,即断开1mol HH键和1 mol II键所需能量小于断开2 mol HI键所需能量,B项错误;
C.由分析可知,ΔH=HH键键能+II键键能-2×HI键键能,即:-a kJ·mol-1=b kJ·mol-1+c kJ·mol-1-2×HI键键能,则断开2mol HI键所需能量约为(c+b+a)kJ,C项正确;
D.该反应为可逆反应,物质不可能完全转化,故向密闭容器中加入2molH2和2molI2,充分反应后放出的热量小于2akJ,D项正确;
答案选B。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能
有效抑制新型冠状病毒(2019-nCoV)的感染。
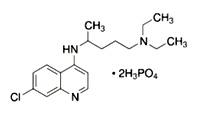
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_______________。P原子核外价层电子排布式为________,其核外电子有____个空间运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________。
(3)H3PO4中PO43- 的空间构型为________________。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________(填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为______________。
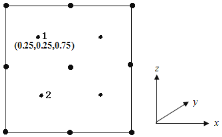
③若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
锂离子电池是一种生活中常见的二次电池,常用于手机、笔记本电脑、电动车中。它主要依靠Li+在正极材料(LixCOO2)和负极材料(石墨)之间往返嵌入和脱嵌来工作。低温时,由于电解液粘度增大,电池中锂离子的迁移能力下降。低温充电时石墨嵌锂速度降低,Li+来不及嵌入石墨中形成LixC,便得到电子被还原,容易在负极表面析出金属锂,降低电池容量,影响电池安全。上海复旦大学开发了一款新型锂离子电池,其放电的工作原理如图1所示。该电池不仅在-40℃下放电比容量没有衰降,甚至在-70℃下该电池的容量保持率也能够达到常温的70%左右,极大地拓展了电池的应用范围。复旦大学团队采用凝固点低、可在极端低温条件下导电的乙酸乙酯基电解液,并采用不需要将锂离子嵌入到电极中即可完成充、放电的有机物电极,避免了低温条件下嵌入过程变慢。请依据文章内容回答下列问题。
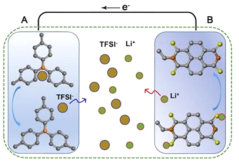
(1)判断下列说法是否正确_________(填“对”或“错”)。
①新型锂离子电池有望在地球极寒地区使用。
②在传统锂离子电池中,金属锂是负极材料。
③若新型锂离子电池在常温下的放电比容量为99mAh·g-1,则其在-40℃下的放电比容量为99mAh·g-1。
(2)新型锂离子电池放电时,正极是_________(填“A”或“B”)。
(3)下列关于该新型锂离子电池可耐低温原因的推测中,不正确的是_________(填字母)。
a.采用与传统不同的有机物电极
b.乙酸乙酯基电解液的凝固点低
c.锂离子不需要在正负极间移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
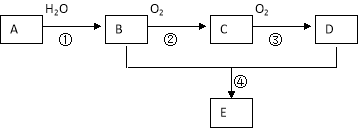
请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 , 。
(3)物质B可以被直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
① ;反应类型: 。
④ ;反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中充入气体A和B,发生A(g)+B(g)C(g)+2D(g) ΔH,所得实验数据如表。下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 300 | 0.40 | 0.10 | 0.090 |
② | 500 | 0.40 | 0.10 | 0.080 |
③ | 500 | 0.20 | 0.05 | a |
A.ΔH>0
B.500 ℃该反应的平衡常数K=0.16 mol·L-1
C.③中达到平衡时,A的转化率大于20%
D.5min末测得①中n(C)=0.050 mol,则0到5min内v(D)=0.02mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将铁片A和碳棒B用导线连接后放入食盐水中模拟菜刀生锈过程,则下列叙述错误的是( )

A. 导线中有电子流动,电流方向为A流向B
B. 溶液中的O2在电极B得电子,电极B附近碱性增强
C. 电极A上的电极反应式为Fe-2e-=Fe2+
D. 溶液中的Na+向电极B附近移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. △H<0的反应一定能自发反应进行。
B. 对于一个给定的反应,选择合适的催化剂可以大幅度提升正逆反应速率和反应物转化率。
C. 铁与稀硫酸反应制取氢气,向溶液中加入少量的CuSO4固体可以加快化学反应速率
D. 在恒温恒压的密闭容器中进行反应2NO+O2![]() 2NO2,达到平衡后充入He,平衡不移动。
2NO2,达到平衡后充入He,平衡不移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R 是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为 1:2,Y 原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为_____,元素Z的离子结构示意图为_____。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__。
(3)元素W非金属性比元素R弱,用原子结构的知识解释原因_____。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式_____。
(5)Y和Z组成的化合物 ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B. 通入N2是防止空气中的O2氧化二价铁元素
C. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的浓度比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com