
【题目】X、Y、Z、W、R 是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为 1:2,Y 原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为_____,元素Z的离子结构示意图为_____。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__。
(3)元素W非金属性比元素R弱,用原子结构的知识解释原因_____。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式_____。
(5)Y和Z组成的化合物 ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为_____________。
【答案】![]()
 8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱 SO2+NH3·H2O=HSO3-+NH4+ Al2O3+3C+N2
8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱 SO2+NH3·H2O=HSO3-+NH4+ Al2O3+3C+N2![]() 2AlN+3CO
2AlN+3CO
【解析】
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,则为碳元素,Y的氧化物和R的氧化物均能形成酸雨,为二氧化氮和二氧化硫,则Y为氮元素,R为硫元素。Y原子和Z原子的核外电子数之和为20,Z为铝元素,W和R是同周期相邻元素,为磷元素,故X、Y、Z、W、R分别为C、N、Al、P、S,由此分析。
(1)X为碳元素,其最高价氧化物为二氧化碳,电子式为![]() ;Z为铝元素,离子结构示意图为
;Z为铝元素,离子结构示意图为 ;
;
(2)铜与氮元素的最高价氧化物对应的水化物的稀溶液即稀硝酸反应生成硝酸铜和一氧化氮和水,方程式为:8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O;
(3)W为磷元素,在ⅤA族。因为P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故非金属性较弱;
(4)二氧化硫能使品红褪色,工业上用氨气吸收过量的二氧化硫,生成亚硫酸氢铵,故离子方程式为:SO2+NH3·H2O=HSO3-+NH4+;
(5)Z的氧化物为氧化铝,X为碳,Y为氮气,三者在高温下反应生成氮化铝,因为Z的氧化物和X单质的物质的量之比为1:3,所以产物为一氧化碳,方程式为:Al2O3+3C+N2![]() 2AlN+3CO。
2AlN+3CO。


科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
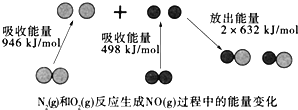
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:已知(a、b、c 均大于零):H2(g)+I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1。
2HI(g) ΔH=-a kJ·mol-1。
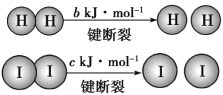
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1mol HH键和1 mol II键所需能量大于断开2 mol HI键所需能量
C.断开2mol HI键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量小于2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为___________________。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
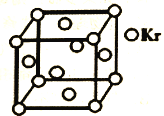
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,则该晶体的密度_____ g/cm3(只列式不计算,Kr摩尔质量为85g·mol—1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用小轿车(燃油汽车)中的动力和能量与化学反应息息相关。
(1)用C8H18代表汽油分子,写出汽油完全燃烧的化学方程式_____。
(2)关于汽油在气缸中燃烧反应的叙述正确的是_____
A.汽油具有的总能量高于生成物二氧化碳和水具有的总能量
B.汽油燃烧过程中,化学能转化为热能
C.断裂汽油和氧气分子中化学键吸收的能量小于生成碳氧化物和水中化学键放出的能量
D.汽车尾气中含NO的原因是汽油中含有氮元素,燃烧后生成NO
(3)汽车中的电瓶为铅酸电池,Pb+PbO2 +2H2SO4![]() PbSO4+2H2O,已知PbSO4难溶于水,下列说法正确的是_____
PbSO4+2H2O,已知PbSO4难溶于水,下列说法正确的是_____
A. 放电时,负极的电极反应式为:Pb-2e-=Pb2+
B.放电时,正极得电子的物质是PbO2
C.放电时,理论上每消耗20.7g铅,外电路中转移的电子为0.4mol
D.充电是使放电时的氧化还原反应逆向进行
(4)研究氢氧燃料电池中,H2所在的电极为_____极(填“正”或“负”),电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
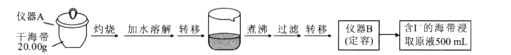
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验一 碘含量的测定
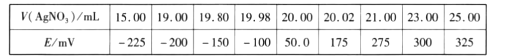
取0.0100 mol/L的 AgNO3标准溶液装入滴定管,取100.00 mL 海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
回答下列问题:
(1)实验中“灼烧”是在___________(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__________________________________
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为___________mL,计算得海带中碘的质量百分含量为_______________________%。
实验二 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
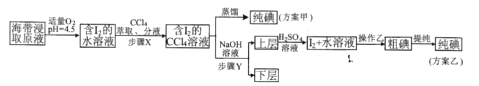
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)“适量O2”中能代替O2的最佳物质对应的电子式为_________________
(5)若要测定“I2+水溶液”中碘的含量,可以选择______________作指示剂,用 Na2S2O3溶液滴定,滴定终点的现象是____________________。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为_________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )
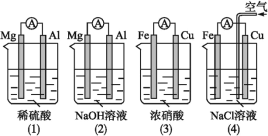
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+D.(4)中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;Y原子的价电子(外围电子)排布为msnmpn;②R原子核外L层电子数为奇数;③Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________,其中心原子的杂化类型是________。
(6)某元素原子的价电子构型为3d54s1,该元素属于________区元素,元素符号是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com