
����Ŀ���Ķ����ģ��ش����⡣
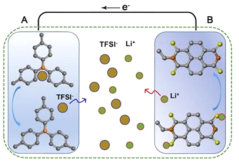
����ӵ����һ�������г����Ķ��ε�أ��������ֻ����ʼDZ����ԡ��綯���С�����Ҫ����Li������������(LixCOO2)��������(ʯī)֮������Ƕ�����Ƕ������������ʱ�����ڵ��Һճ�������������ӵ�Ǩ�������½������³��ʱʯīǶ��ٶȽ��ͣ�Li��������Ƕ��ʯī���γ�LixC����õ����ӱ���ԭ�������ڸ���������������ﮣ����͵��������Ӱ���ذ�ȫ���Ϻ�������ѧ������һ����������ӵ�أ���ŵ�Ĺ���ԭ����ͼ1��ʾ���õ�ز�����-40���·ŵ������û��˥����������-70���¸õ�ص�����������Ҳ�ܹ��ﵽ���µ�70%���ң��������չ�˵�ص�Ӧ�÷�Χ��������ѧ�ŶӲ������̵�͡����ڼ��˵��������µ�����������������Һ�������ò���Ҫ�������Ƕ�뵽�缫�м�����ɳ䡢�ŵ���л���缫�������˵���������Ƕ����̱������������������ݻش��������⡣
(1)�ж�����˵���Ƿ���ȷ_________(����������������)��
����������ӵ�������ڵ�������ʹ�á�
���ڴ�ͳ����ӵ���У�������Ǹ������ϡ�
������������ӵ���ڳ����µķŵ������Ϊ99mAh��g-1��������-40���µķŵ������Ϊ99mAh��g-1��
(2)��������ӵ�طŵ�ʱ��������_________(����A������B��)��
(3)���й��ڸ���������ӵ�ؿ��͵���ԭ����Ʋ��У�����ȷ����_________(����ĸ)��
a�������봫ͳ��ͬ���л���缫
b���������������Һ�����̵��
c������Ӳ���Ҫ�����������ƶ�
���𰸡�����ȷ���ڴ�����ȷ A c
��������
��϶����ṩ����Ϣ��ԭ��ػ�ѧԭ���������⡣
(1)����������ӵ����-40C�·ŵ������û��˥������-700C�µ�ص�����������Ҳ�ܴﵽ���µ�70%���ң�������������ӵ�������ڵ�������ʹ�ã��ʢ���ȷ��
�ڴ�ͳ����ӵ������������( LixCoO2)������������ʯī��Li+Ƕ��ʯī���γ�LixC��LixCʧȥ���ӣ���ع����ŵ磬�ʢڴ���
�۵����-40C�·ŵ������û��˥��������������ӵ���ڳ����º�-40C�µķŵ��������ȣ���Ϊ99 mAhg-1���ʢ���ȷ��
(2)ԭ��ع���ʱ���������Һ�У���������������������������������������ӷŵ�ԭ��ͼ��֪��Li+��B�缫����A�缫��TFSI-��A�缫����B�缫������B�缫Ϊ������A�缫Ϊ������
(3)a����������ӵ�ؿ��ܲ��ÿ�����ɳ䡢�ŵ���л���缫���������������Ƕ����̱���������ߵ�صķŵ����������a��ȷ��
b����������ӵ�ؿ��ܲ��ü��˵����������ܵ�����������������Һ���������������Ƕ����̱�����˵���������������Һ���̵�ͣ���b��ȷ��
c������ӵ����Ҫ����Li+���������Ϻ�������֮������Ƕ�����Ƕ������������������������ƶ����γɱպ�ͨ·������磬��c����
�ʴ�Ϊ��c��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѧУ��ѧ�о�С���ʵ����ij��Һ�������Һ���м�������������裺����Һ�п��ܺ���NH4+��K+��Al3+��HCO3-��Cl-��I-��SO42-�������еļ������ӡ�ʵ��̽����
��ȡ��������Һ�μ���ɫʯ����Һ����Һ��졣
��ȡ100mL����Һ���Թ��У��μ�����Ba(NO3)2��Һ����ϡ�����ữ����˵õ�0.3mol��ɫ�����ף�����Һ�м���AgNO3��Һδ������������
����ȡ100mL����Һ������Na2O2��ĩ�������ij���������������Na2O2��ĩ���ʵ����Ĺ�ϵ������ͼ��ʾ������˵���в���ȷ���ǣ� ��
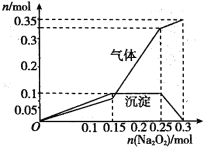
A.����Һ��һ��������I-��HCO3-��Cl-
B.����Һ��һ������K+�������ʵ���Ũ��Ϊ1molL-1
C.����Һ�м���0.25~0.3molNa2O2ʱ��������Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2H2O=4NaOH+O2����Al(OH)3+NaOH=NaAlO2+2H2O
D.����Һ��ʹ��ɫʯ����Һ����Ψһԭ����NH4+����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ����������ӣ�H+��Mg2+��Al3+��NH![]() ��Cl-��AlO
��Cl-��AlO![]() ���������Һ����μ���NaOH��Һʱ���������������ʵ���(n)�����NaOH��Һ�����(V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
���������Һ����μ���NaOH��Һʱ���������������ʵ���(n)�����NaOH��Һ�����(V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
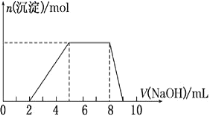
A.ԭ��Һ��һ�����е���������H+��Mg2+��Al3+��NH![]()
B.��Ӧ����γɵ���Һ�е����ʺ�AlCl3
C.ԭ��Һ��Al3+��NH![]() �����ʵ���֮��Ϊ1��3
�����ʵ���֮��Ϊ1��3
D.ԭ��Һ�к��е���������Cl-��AlO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯������˵���������
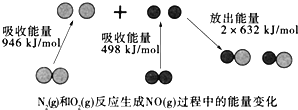
A. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+O2��g���T2NO��g����H=+180kJ��mol��1
B. 1mol N2��l����NA��O2��l����Ӧ����2mol NO��g��ʱ�����յ�����Ϊ180kJ
C. 1mol N2��g����1mol O2��g�������������2mol NO��g�����������
D. ͨ������£�N2��g����O2��g����ϲ���ֱ������NO��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�����£��ֱ��÷�Ӧ2SO2(g)��O2(g)![]() 2SO3(g)�Ļ�ѧ��Ӧ���ʣ����б�ʾ�÷�Ӧ���е������ǣ�������
2SO3(g)�Ļ�ѧ��Ӧ���ʣ����б�ʾ�÷�Ӧ���е������ǣ�������
A. ��(SO2)=4 mol��L��1��min��1B. ��(O2)=3 mol��L��1��min��1
C. ��(SO2)=0.1 mol��L��1��s��1D. ��(O2)=0.1 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��������У�����˵����Ӧ��C(s) +CO2(g)![]() 2CO(g)�Ѵﵽƽ��״̬����
2CO(g)�Ѵﵽƽ��״̬����
A. ÿ����1 mol CO2��ͬʱ����2 mol CO
B. ��������ƽ����Է����������ٸı�
C. �����������ѹǿ���ٸı�
D. ������������ܶȲ��ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���Ԫ����������ѧϰ���о����к���Ҫ�����á��±���Ԫ�����ڱ���5��Ԫ�ص������Ϣ������Q��W��Xλ��ͬһ���ڡ�
Ԫ�� | ��Ϣ |
Q | �ؿ��к�����2��Ԫ�� |
W | ��������ϼ�Ϊ+7�� |
X | ����������Ӧ��ˮ�����ڱ������м�����ǿ |
Y | ��ɫ��ӦΪ��ɫ |
Z | ԭ�ӽṹʾ��ͼΪ |
��1��Q��Ԫ�����ڱ��е�λ����___________��
��2��Q��W������������Ӧ��ˮ�����У����Խ�ǿ��������___________�����ѧʽ��
��3��������Yǿ��X����ԭ�ӽṹ����ԭ��___________��ʧ��������Y����X������Ԫ�ط��Żش����⣩
��4�����ж���Z���仯������ƶ��У���ȷ����___________������ţ���
��Z��������ϼ���W��������ϼ���ͬ
��Z���⻯����ȶ�������W���⻯����ȶ���
��Z�ĵ��ʿ���X��W�γɵĻ������ˮ��Һ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ����֪��a��b��c �������㣩��H2(g)��I2(g)![]() 2HI(g) ��H����a kJ��mol��1��
2HI(g) ��H����a kJ��mol��1��
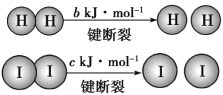
����˵������ȷ���ǣ� ��
A.��Ӧ��������������������������
B.�Ͽ�1mol HH����1 mol II�������������ڶϿ�2 mol HI����������
C.�Ͽ�2mol HI����������ԼΪ(c��b��a)kJ
D.���ܱ������м���2molH2��2molI2����ַ�Ӧ��ų�������С��2akJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��صĵ缫���Ʋ�����缫���ϵ������й���Ҳ��������Һ�йء�����˵������ȷ����(����)
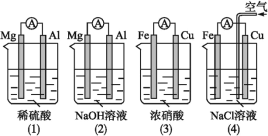
A.(1)(2)��Mg��������(3)(4)��Fe������B.(2)��Mg���������缫��ӦʽΪ6H2O+6e-=6OH-+3H2��
C.(3)��Fe���������缫��ӦʽΪFe-2e-=Fe2+D.(4)��Cu���������缫��ӦʽΪ2H++2e-=H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com