
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中5种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 地壳中含量第2的元素 |
W | 最高正化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色反应为紫色 |
Z | 原子结构示意图为 |
(1)Q在元素周期表中的位置是___________。
(2)Q、W的最高价氧化物对应的水化物中,酸性较强的物质是___________。(填化学式)
(3)金属性Y强于X,用原子结构解释原因:___________,失电子能力Y大于X。(用元素符号回答问题)
(4)下列对于Z及其化合物的推断中,正确的是___________(填序号)。
①Z的最低负化合价与W的最低负化合价相同
②Z的氢化物的稳定性弱于W的氢化物的稳定性
③Z的单质可与X和W形成的化合物的水溶液发生置换反应
【答案】第3周期、第ⅣA族 HClO4 同主族电子层增多,失电子能力增强 ①②
【解析】
Q是地壳中含量第2的元素,则Q为Si;Q、W、X位于同一周期,均在第三周期,W的最高正化合价为+7价,W为Cl;X的最高价氧化物对应的水化物在本周期中碱性最强,X为Na;Y的焰色反应为紫色,Y为K,Z的原子结构示意图为  ,Z为Br,以此来解答。
,Z为Br,以此来解答。
由分析知:Q为Si、W为Cl、X为Na、Y为K、Z为Br;
(1)Q为Si,核电荷数为14,其在元素周期表中的位置是第3周期、第ⅣA族;
(2)非金属性越强,对应最高价含氧酸的酸性越强,Cl的非金属性比Si强,则Si、Cl的最高价氧化物对应的水化物中,酸较强的物质是HClO4;
(3)金属性Y强于X,用原子结构解释原因:K、Na同属于一个主族,且钾的电子层数大于钠的电子层数,原子半径越大,失电子能力增强,所以失去电子能力K大于Na;
(4)①Cl和Br为同主族元素,最低负化合价均为-1价,故①正确;
②非金属性Cl>Br,则HBr的氢化物的稳定性弱于HCl的稳定性,故②正确;
③Br的非金属性小于Cl,则Br2与NaCl溶液不能发生置换反应生成Cl2,故③错误;
故答案为:①②。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-110kJmol-1
2NO2(g) ΔH=-110kJmol-1
T1℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中(忽略NO2与N2O4的转化)。
(1)下列可以作为反应已经到达平衡状态的判断依据的是____。
A.2v正(O2)=v逆(NO2)
B.NO与O2的物质的量之比为2:1
C.容器内混合气体的密度保持不变
D.K不变
E.容器内混合气体的颜色保持不变
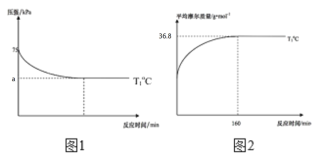
(2)通过现代科学技术动态跟踪反应的进行情况,得到容器内混合气体的压强、平均摩尔质量随反应时间的变化曲线如图1图2所示。则反应2NO(g)+O2(g)![]() 2NO2(g)在T1℃时的平衡常数Kp=____。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=px(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。保持其它条件不变,仅改变反应温度为T2℃(T2>T1),在图2中画出容器内混合气体的平均摩尔质量随反应时间的变化趋势图_____。
2NO2(g)在T1℃时的平衡常数Kp=____。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=px(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。保持其它条件不变,仅改变反应温度为T2℃(T2>T1),在图2中画出容器内混合气体的平均摩尔质量随反应时间的变化趋势图_____。
II.NO的工业处理
(3)H2还原法:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH1
N2(g)+2H2O(g) ΔH1
已知在标准状况下,由元素最稳定的单质生成1mol纯化合物时的焓变叫做标准摩尔生成焓。NO(g)和H2O(g)的标准摩尔生成焓分别为+90kJmol-1、-280kJmol-1。则ΔH1=____。
(4)O3-CaSO3联合处理法
NO可以先经O3氧化,再用CaSO3水悬浮液吸收生成的NO2,转化为HNO2。已知难溶物在溶液中并非绝对不溶,同样存在着一定程度的沉淀溶解平衡。在CaSO3水悬浮液中加入Na2SO4溶液能提高SO32-对NO2的吸收速率,请用平衡移动原理解释其主要原因____。
(5)电化学处理法
工业上以多孔石墨为惰性电极,稀硝酸铵溶液为电解质溶液,将NO分别通入阴阳两极,通过电解可以得到浓的硝酸铵溶液。则电解时阳极发生的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是( )
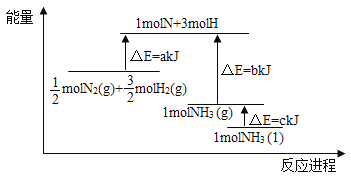
A. 若合成氨反应使用催化剂,反应放出的热量增多
B. 断裂0.5moIN2(g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3(l)= N2(g)+3H2(g) △H=2(b+c-a) kJ/mol
D. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
锂离子电池是一种生活中常见的二次电池,常用于手机、笔记本电脑、电动车中。它主要依靠Li+在正极材料(LixCOO2)和负极材料(石墨)之间往返嵌入和脱嵌来工作。低温时,由于电解液粘度增大,电池中锂离子的迁移能力下降。低温充电时石墨嵌锂速度降低,Li+来不及嵌入石墨中形成LixC,便得到电子被还原,容易在负极表面析出金属锂,降低电池容量,影响电池安全。上海复旦大学开发了一款新型锂离子电池,其放电的工作原理如图1所示。该电池不仅在-40℃下放电比容量没有衰降,甚至在-70℃下该电池的容量保持率也能够达到常温的70%左右,极大地拓展了电池的应用范围。复旦大学团队采用凝固点低、可在极端低温条件下导电的乙酸乙酯基电解液,并采用不需要将锂离子嵌入到电极中即可完成充、放电的有机物电极,避免了低温条件下嵌入过程变慢。请依据文章内容回答下列问题。
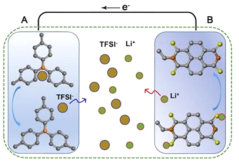
(1)判断下列说法是否正确_________(填“对”或“错”)。
①新型锂离子电池有望在地球极寒地区使用。
②在传统锂离子电池中,金属锂是负极材料。
③若新型锂离子电池在常温下的放电比容量为99mAh·g-1,则其在-40℃下的放电比容量为99mAh·g-1。
(2)新型锂离子电池放电时,正极是_________(填“A”或“B”)。
(3)下列关于该新型锂离子电池可耐低温原因的推测中,不正确的是_________(填字母)。
a.采用与传统不同的有机物电极
b.乙酸乙酯基电解液的凝固点低
c.锂离子不需要在正负极间移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
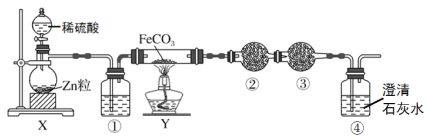
A.通过调节分液漏斗的活塞以控制①中气泡产生快慢
B.装置①的作用是干燥氢气
C.装置②、③中的药品分别是无水硫酸铜、碱石灰
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
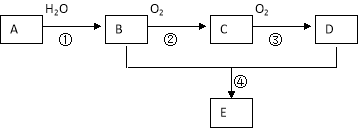
请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 , 。
(3)物质B可以被直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
① ;反应类型: 。
④ ;反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中充入气体A和B,发生A(g)+B(g)C(g)+2D(g) ΔH,所得实验数据如表。下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 300 | 0.40 | 0.10 | 0.090 |
② | 500 | 0.40 | 0.10 | 0.080 |
③ | 500 | 0.20 | 0.05 | a |
A.ΔH>0
B.500 ℃该反应的平衡常数K=0.16 mol·L-1
C.③中达到平衡时,A的转化率大于20%
D.5min末测得①中n(C)=0.050 mol,则0到5min内v(D)=0.02mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. △H<0的反应一定能自发反应进行。
B. 对于一个给定的反应,选择合适的催化剂可以大幅度提升正逆反应速率和反应物转化率。
C. 铁与稀硫酸反应制取氢气,向溶液中加入少量的CuSO4固体可以加快化学反应速率
D. 在恒温恒压的密闭容器中进行反应2NO+O2![]() 2NO2,达到平衡后充入He,平衡不移动。
2NO2,达到平衡后充入He,平衡不移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
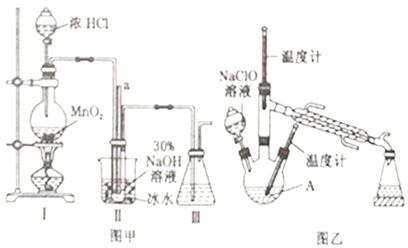
实验1:制备NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为________________________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有_______________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是________________________。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分N2H4·H2O会参与A 中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为__________________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入适量NaHCO3固体,则测量结果会___________“偏大”“ 偏小”“ 无影响”)。
②下列能导致馏分中水合肼的含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com