
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_____________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中的c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中的c(NH4+)。
(3)浓度均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示:

①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________,导致pH随温度变化的原因是________________________________________________;
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO42-)-c(NH4+)-3c(Al3+)=____________。
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示:
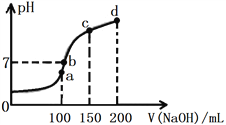
试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________________。
(5)难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(Al3+)=0.1molL﹣1,使Al3+开始沉淀的pH为________。(25℃时,Al(OH)3的Ksp=1×10-34)
【答案】 Al3+ + 3H2O ![]() Al(OH)3(胶体) + 3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降,从而达到净水目的 小于 I NH4Al(SO4)2水解使溶液呈酸性,升高温度使NH4+、Al3+水解程度增大,pH减小 10-3 mol·L-1 或(10-3 - 10-11)mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) 3
Al(OH)3(胶体) + 3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降,从而达到净水目的 小于 I NH4Al(SO4)2水解使溶液呈酸性,升高温度使NH4+、Al3+水解程度增大,pH减小 10-3 mol·L-1 或(10-3 - 10-11)mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) 3
【解析】(1) Al3+ 为弱碱的阳离子,水解生成Al(OH)3胶体,Al3+ + 3H2O ![]() Al(OH)3(胶体) + 3H+,胶体具有较强的吸附能力,可除去颗粒状杂质,使水达到净化的目的;
Al(OH)3(胶体) + 3H+,胶体具有较强的吸附能力,可除去颗粒状杂质,使水达到净化的目的;
(2) 在NH4Al(SO4)2溶液中,NH4+和Al3+ 都是弱碱的阳离子,水解呈酸性,所以Al3+ 的水解对NH4+的水解起抑制作用,但抑制程度不大,而在NH4HSO4溶液中,完全电离出来的H+浓度很大,对NH4+的水解抑制程度很大,所以前者的c(NH4+)小于后者的c(NH4+);
(3) ① NH4Al(SO4)2在溶液中因水解使溶液呈酸性,即pH<7, 又水解是吸热反应,随着温度的升高,水解程度增大,生成的c(H+)增大,pH减小,因此曲线I是正确的;② 20 ℃ 时,NH4Al(SO4)2溶液的pH=3, 即c(H+)=1.0×10-3 mol·L-1,溶液中存在的电荷守恒为2c(SO42-) +c(OH-)=c(NH4+) +3c(Al3+)+ c(H+),则2c(SO42-)-c(NH4+)-3c(Al3+)= c(H+)- c(OH-)= 1.0×10-3 mol·L-1—1.0×10-11 mol·L-1=1.0×10-3 mol·L-1;
(4) NH4HSO4完全电离产生的H+抑制水的电离,使水的电离程度减小,NH4+的水解促进水的电离,使水的电离程度增大,但水解程度很小,所以H+抑制水的电离是主要的,此时水的电离程度很小,随着NaOH的加入,当H+被完全中和后,NH4+的水解促进水的电离起主要作用,溶液呈弱酸性,水的电离程度最大,即图象中的a点水的电离程度最大;在b点pH=7,即c(H+)=c(OH-)1.0×10-7 mol·L-1,溶液呈中性,此时溶液中发生的反应为2NH4HSO4 +2NaOH= (NH4)2SO4+Na2SO4+ H2O和极少量的(NH4)2SO4+2NaOH= Na2SO4+ NH3·H2O,因此溶液中c(Na2SO4)> c[(NH4)2SO4],则有c(Na+)>c(SO42-)> c(NH4+) >c(OH-) =c(H+)。
(5)已知25℃ Al(OH)3的Ksp=1×10-34,当c(Al3+)=0.1 molL﹣1时,要使Al3+开始沉淀则c(OH-)=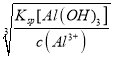 =
=![]() =1×10-11 molL﹣1,求得pH=3。
=1×10-11 molL﹣1,求得pH=3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下面的排序错误的是( )
A. 晶体熔点由高到低:MgO>H2O>NH3
B. 熔点由高到低:金刚石>生铁>纯铁>钠
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 石油、沼气、天然气、植物油都属于可再生能源
B. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
C. 水蒸气变为液态水时放出的能量就是该变化的反应热
D. 同温同压下,H2(g)+Cl2(g) ![]() 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述正确的是( )
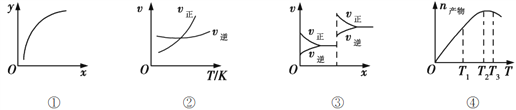
A. 图①表示在恒容容器中MgSO4(s) + CO(g)![]() MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)![]() 2C(g)的反应速率随温度变化的图像,正反应ΔH>0
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)![]() 2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料是当前新能源领域研究的一类热门材料。在一定条件下,以Cu-Zn原电池作电源,利用图所示装置可实现有机物的储氢,下列有关说法正确的是( )
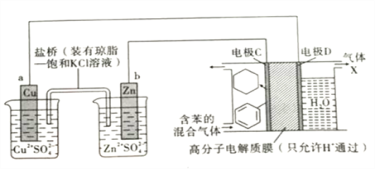
A.在Cu-Zn原电池装置工作时,盐桥内的Cl-向铜电极一端移动
B.电极C为阳极,在电极D上发生还原反应
C.气体X的主要成分是H2
D.H+透过高分子膜从右室进入左室,在电极C上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中过氧化钠(Na2O2)中氧元素化合价为______,氧化产物是________________(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_____________________________________________。
②每生成1 mol FeO42—转移________mol电子;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2 ,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为__________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com