
����Ŀ�������仯�����ڹ�ũҵ�������������������Ҫ���á�
(1)������һ����Ҫ�Ļ���ԭ�ϣ���̬�����dz��õķ��ϡ�
�������ϳɰ���������ط�ӦΪ:N2(g)+3H2(g)![]() 2NH3(g) ��H=-93kJ/mol��ʵ�������У����ù���������Fe�������������¶�773K��ѹǿ3.0��107Pa��ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��
2NH3(g) ��H=-93kJ/mol��ʵ�������У����ù���������Fe�������������¶�773K��ѹǿ3.0��107Pa��ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��
�ٺϳɰ������ǵ��Ĺ̶���һ�֣�����______(ѡ���������̵�����������̵������˹��̵���)��
�ںϳɰ���Ӧ��������ý���������й��ڴ�����˵������ȷ����_________��
A.���Լӿ췴Ӧ���� B.���Ըı䷴Ӧ��
C.���Լ��ٷ�Ӧ�е��ܺ� D.�������ӻ���ӵ���Ŀ
�۹��ںϳɰ����յ��������⣬��ȷ����_________��
A.ԭ������N2����������N2����ã��ʶȹ������������H2��ת����
B.�����¶�(773K)Զ�������£���Ϊ�˱�֤�����ܸߵ�ƽ��ת���ʺͿ�ķ�Ӧ����
C.���¶ȡ�ѹǿһ��ʱ����ԭ����(N2��H2�ı�������)�����������������壬���������ƽ��ת����
D.��������ɵ�N2��ͨ����Ȼ����ˮ����ת���ɵ�H2��ԭ�����뾭�������������Է�ֹ�����ж��Ͱ�ȫ�¹ʷ���
(2)��(N2H4)�ǵ����⻯��֮һ�����Ʊ��������ô����������������İ�����
�ٴ���������Һ�Լ��ԣ���ʾԭ�������ӷ���ʽ��_________________________��
�ڳ����£���ˮ�ⷴӦ��ƽ�ⳣ��ΪK=1.0��10-6mol/L����1.0mol/LNaClO��Һ��pH=____��
������N2O4������Ӧ����N2��ˮ������
��֪��N2(g)+2O2(g)=N2O4(l) ��H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-534.2kJ/mol
��д���º�N2O4��Ӧ���Ȼ�ѧ��Ӧ����ʽ_________________________________��
(3)��NH4HCO3��Һ�У���ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=_____��(��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7)��
NH3��H2O+H2CO3��ƽ�ⳣ��K=_____��(��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7)��
���𰸡��˹��̵� BC AD ClO-+H2O![]() HClO+OH- 11 2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ��H=-1048.9kJ/mol 1.25��103
HClO+OH- 11 2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ��H=-1048.9kJ/mol 1.25��103
��������
(1)���ɵ�Ԫ�صĵ��ʱ�Ϊ���Ļ�����Ĺ���Ϊ���Ĺ̶����ɸ��ݵ��̶���ʽ�жϹ̶���ʽ��
�ڴ����ɽ��ͷ�Ӧ�Ļ�ܣ������Ӱٷ������ӿ컯ѧ��Ӧ���ʵ�����ʹ��Ӧƽ�ⷢ���ƶ���
�۸��ݺϳɰ����ķ�Ӧ�����������С�ķ��ȷ�Ӧ���ӻ�ѧ��Ӧ���ʺͻ�ѧƽ���ƶ��Ƕȷ�����������Ժϳɰ�����Ӧ��Ӱ�죻
(2)�ٸ��ݴ���������ǿ�������Σ������ε�ˮ����ɷ�����
�ڸ���ˮ��ƽ�ⳣ���ĺ��������Һ��c(OH-)��Ȼ������ˮ�����ӻ�����c(H+)�ٸ���pH=-lg(H+)����pH��
�۸��ݸ�˹���ɣ��������Ȼ�ѧ����ʽ���ӣ��ɵ���Ӧ���Ȼ�ѧ����ʽ��
(3)����ˮ��ƽ�ⳣ���ı���ʽ��Kb��Ka1��ˮ�����ӻ��Ĺ�ϵ���㡣
(1)��N2��H2�ڴ�������ʱ���ڸ��¡���ѹ�����·�����Ӧ����NH3���÷�Ӧ���ڵ��Ĺ̶������˹��̵���
��A.����ý�Ǻϳɰ����Ĵ��������ڽ����˷�Ӧ�Ļ�ܣ�ʹ����ķ��ӱ�Ϊ����ӣ�����������ӣ���Ӧ���ʼӿ죬A��ȷ��
B.�������Ըı䷴Ӧ;���������ܸı����ʵ�ʼ̬����̬����˲����Ըı䷴Ӧ�ȣ�B����
C.���ڴ������ܸı����ʵ�ʼ̬����̬����˲��ܸı䷴Ӧ���̵������仯�����Բ��ܼ��ٷ�Ӧ�е��ܺģ�C����
D.���ڴ����ɽ��ͷ�Ӧ�Ļ�ܣ�ʹ�������ͨ���ӱ�Ϊ����ӣ����Կ������ӻ���ӵ���Ŀ��D��ȷ��
�ʺ���ѡ����BC��
��A.�ϳɰ�����N2��H2��Ӧ�����ʵ����ı���1��3�������ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��N2����������N2����ã��ʶȹ������Լӿ췴Ӧ���ʣ�����������һ�ַ�Ӧ���Ũ�ȣ�����ʹ��ѧƽ�������ƶ����Ӷ�����ʹ������Ӧ���ת������ߣ��Ӷ������H2��ת���ʣ�A��ȷ��
B.�����¶�(773K)Զ�������£���Ҫ����Ϊ�ڴ��¶��´����Ļ���������ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����������¶ȣ���ѧƽ�������ƶ�����Ӧ��ƽ��ת���ʽ��ͣ�B����
C.���¶ȡ�ѹǿһ��ʱ����ԭ����(N2��H2�ı�������)�����������������壬���ڲ��ܸı��κ�һ�ַ�Ӧ���Ũ�ȣ���˶�����ƽ��ת������Ӱ�죬C����
D.��������Ҫ�ɷ���N2��O2����������ɵ�N2��ͨ����Ȼ����ˮ����ת���ɵ�H2��ԭ����N2��H2���뾭�������������Է�ֹ�����ж�����ʧȥ�����Լ�������ȫ�¹ʷ�����D��ȷ��
�ʺ���ѡ����AD��
(2)�ٴ���������ǿ�������Σ�����Һ��ClO-�ᷢ��ˮ�ⷴӦ��ClO-+H2O![]() HClO+OH-�����մﵽƽ��ʱ����Һ��c(OH-)>c(H+)��������Һ�Լ��ԣ�
HClO+OH-�����մﵽƽ��ʱ����Һ��c(OH-)>c(H+)��������Һ�Լ��ԣ�
��ClO-��ˮ��ƽ�ⳣ��K=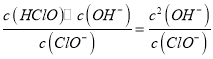 =1.0��10-6mol/L��c2(OH-)=1.0mol/L��1.0��10-6mol/L=1.0��10-6mol2/L2������c(OH-)=1.0��10-3mol/L����c(H+)=
=1.0��10-6mol/L��c2(OH-)=1.0mol/L��1.0��10-6mol/L=1.0��10-6mol2/L2������c(OH-)=1.0��10-3mol/L����c(H+)=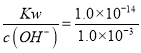 =1.0��10-11mol/L��������Һ��pH=11��
=1.0��10-11mol/L��������Һ��pH=11��
��(i)N2(g)+2O2(g)=N2O4(l) ��H=-19.5kJ/mol
(ii)N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-534.2kJ/mol
(ii)��2-(i)�������ɵ�2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ��H=-1048.9kJ/mol
(3)��ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=
NH3��H2O+H2CO3��ƽ�ⳣ��K=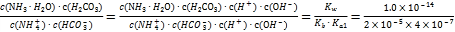 =1.25��10-3��
=1.25��10-3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����Ũ������ͭ��Ӧ��ʵ������У��۲쵽ͭƬ�����ڣ����ǶԺ�ɫ���ʵ���ɽ���ʵ��̽����
��1��������ͼ��ʾװ�ý���ʵ��1�������Ⱥͼг���������ȥ��

ʵ��1��ͭƬ��Ũ���ᷴӦ
���� | ���� |
���ȵ�120��~250�� | ͭƬ�����ڣ��д�������������γ�ī��ɫ��Һ |
����������338�� | ͭƬ�Ϻ�ɫ��ʧ��ƿ�г���������������Һ�Դ���ɫ��ƿ�ײ��н϶�Ұ�ɫ���� |
��װ��B��������________��װ��C��ʢ�ŵ��Լ���_______��
��Ϊ֤��Aװ���лҰ�ɫ��������Ҫ�ɷ�Ϊ����ͭ��ʵ�������������___________��
��2��̽��ʵ��1��120��~250��ʱ���ú�ɫ����ijɷ֡�
��������롿��ɫ�����п��ܺ���CuO��CuS��Cu2S�е�һ�ֻ��֡�
���������ϡ�
����1�������軯��[K4Fe(CN��6]��Cu2+����������������Cu2+����Һ�еμ������軯����Һ�����ɺ���ɫ������
����2��
CuS | Cu2S |
��ɫ�ᾧ���ĩ | �Һ�ɫ�ᾧ���ĩ |
������ϡ����������������Ũ��ˮ���ȵ�Ũ���� | ������ϡ�����Ũ����������������Ũ��ˮ |
����Ʋ�ʵʩʵ�顿
ʵ��2.̽����ɫ�������Ƿ�CuO
���� | ���� |
i.ȡ���渽�ź�ɫ�����ͭƬ5Ƭ������ˮϴ�ɾ�������ʢ��10mL�Լ�A��С�ձ��У����� | ��ɫ�������䣬¶��������ͭƬ |
ii.ȡ��ͭƬ������ɫ�������� | �ϲ���Һ���塢��ɫ |
���Լ�A��_________��
�ڼ���Ϊii����Һ��ɫ�п�����Cu2+Ũ��̫С�����Dz���ʵ��ȷ������Һ�в���Cu2+�������ʵ�������������______��
ʵ��3.̽����ɫ�������Ƿ�CuS��Cu2S
���� | ���� |
i.ȡʵ��2�к�ɫ������������������Ũ��ˮ������ | ����ʣ�࣬��Һ�ֽ��߸�������Һ��dz��ɫ |
ii.��ȡʵ��2�к�ɫ������������������Ũ���ᣬ�Ⱥ��� | �й���ʣ�࣬��Һ���dz��ɫ |
����ý��ۡ���ʵ��2��ʵ��3�ɵõ��Ľ����ǣ�ʵ��1�У�120��~250��ʱ���ú�ɫ������_______��
��ʵ�鷴˼��
����ʵ��1��338��ʱ���������ԭ��ͬѧ����Ϊ�ǽϵ��¶�ʱ�����ĺ�ɫ�������ȵ�Ũ�����һ����Ӧ��ɡ���֪��Ӧ�ĺ���������ˮ����ͭ��ж����������ɫ������ʧʱ���ܷ��������з�Ӧ�Ļ�ѧ����ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ��Ϊ![]() ������ֱ���μ��뵽
������ֱ���μ��뵽![]() ������һԪ��MOH��ROH��Һ�У�pH��������Һ����ı仯��ͼ��ʾ������˵����ȷ����
������һԪ��MOH��ROH��Һ�У�pH��������Һ����ı仯��ͼ��ʾ������˵����ȷ����![]()
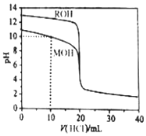
A.![]() ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�
ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�![]()
B.������MOH��ROH��Һ�������Ϻ�������ζ���MOHǡ�÷�Ӧʱ����Һ������Ũ�ȵĹ�ϵ�ǣ�![]()
C.![]() ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�
ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�![]()
D.![]() ʱ�������ܴ��ڣ�
ʱ�������ܴ��ڣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�д��ڵ���ƽ��CH3COOH![]() H����CH3COO����������������ȷ����( )
H����CH3COO����������������ȷ����( )
A�������¶ȣ�ƽ�������ƶ�������ĵ��볣��Kaֵ����
B��0.10mol/L��CH3COOH��Һ�м�ˮϡ�ͣ���Һ��c(OH��)����
C��CH3COOH��Һ�м�������CH3COONa���壬ƽ�������ƶ�
D��25��ʱ����ʹ������ҺpH�����볣��Ka�͵���̶ȶ���С���ɼ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ϴ�����58��2����SiO2��21��0����ZnO��4��5����ZnS��12��8����CuS��ijͬѧ�Ը÷ϴ���Ϊԭ�ϣ��������е�п��ͭ�����õ�ʵ�鷽�����£�

��֪��1��������з����Ļ�ѧ��ӦΪ��������ԭ��Ӧ 2������2����Ҫ�ɷ���SiO2��S������˵������ȷ����
A. ����٣������ͨ����н���
B. ����ٺۣ͢�˵��CuS������ϡ�����ZnS����ϡ����
C. ����ۣ��漰�����ӷ�ӦΪCuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. ����ں͢ܣ������������ᾧ�ķ�ʽ��ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������SO2��NO2������˵���������
A. ������NaOH��Һ��Ӧ����������B. ����ʹʯ����Һ���
C. ��������⻯ѧ�����Ĵ�����Ⱦ��D. ��ҵ�����ᡢ����ʱҪ�õ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ2CH3OH(g) ![]() CH3OCH3(g)��H2O(g)����ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ���е�ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g)��H2O(g)����ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ���е�ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/mol��L��1 | 0.44 | 0.6 | 0.6 |
������������ȷ����(����)
A.�÷�Ӧ��ƽ�ⳣ������ʽΪK��![]()
B.ƽ��ʱc(CH3OH)��0.04 mol��L��1
C.��ʱ�������淴Ӧ���ʵĴ�С��v����v��
D.������CH3OH��10 min��Ӧ�ﵽƽ�⣬��ʱ���ڷ�Ӧ����v(CH3OH)��1.6 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����0.5 mol��L1CH3COONa��Һ��0.5 mol��L1 CuSO4��Һ�Լ�H2O��pH���¶ȱ仯��������ͼ��ʾ������˵����ȷ����

A. ���¶����ߣ���ˮ��c(H+)>c(OH)
B. ���¶����ߣ�CH3COONa��Һ��c(OH)��С
C. ���¶����ߣ�CuSO4��Һ��pH�仯��Kw�ı���ˮ��ƽ���ƶ���ͬ���õĽ��
D. ���¶����ߣ�CH3COONa��Һ��CuSO4��Һ��pH�����ͣ�����ΪCH3COO��Cu2+ˮ��ƽ���ƶ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ʵ�����к͵ζ�����(����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮)������0.001 mol��L��1KMnO4������Һ�ζ�δ֪Ũ�ȵ���ɫNaHSO3��Һ����Ӧ�����ӷ���ʽ�ǣ�2MnO4����5HSO3����H����2Mn2����5SO42����3H2O
�ش��������⣺
(1)��________(����������������)ʽ�ζ���ʢ�Ÿ��������Һ��
(2)�õζ�ʵ��ѡ�ú���ָʾ����˵������____________________(���������ָʾ��Ҳ��˵������)��
(3)�ζ�ǰƽ��KMnO4��ҺҺ�棬�̶�Ϊa mL���ζ�����Һ��̶�Ϊb mL�������(b��a)mL����õ��Ĵ���Ũ�ȣ���ʵ��Ũ��________(������������С��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com